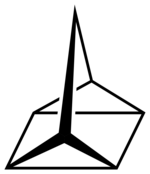
Quadricyclan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Quadricyclan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H8 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,982 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
108–111 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Quadricyclan ist ein gespannter, multicyclischer Kohlenwasserstoff, der als potentieller Kandidat für Raketentreibstoffe und zur Speicherung von Sonnenenergie diskutiert wird. Diese Anwendungen sind limitiert durch die relativ niedrige Zersetzungstemperatur von unter 400 °C.
Struktur und Eigenschaften
Quadricyclan ist ein hochgespanntes Molekül (329,5 kJ/mol). Die Isomerisierung zu Norbornadien geschieht ohne Katalysatoren bei niedrigen Temperaturen langsam.[4] Wegen seiner gespannten Struktur und thermischen Stabilität wurde es intensiv untersucht.
Herstellung
Quadricyclan wird durch Bestrahlung von Norbornadien mit UV-Strahlung von ca. 300 nm in Gegenwart von Sensibilisierern wie Michlers Keton hergestellt.[5][6] Andere Sensibilisierer wie Aceton, Kupfer(I)-chlorid[7], Benzophenon, Acetophenon, können auch genutzt werden, ergeben aber schlechtere Ausbeuten.

Reaktion von Norbornadien zu Quadricyclan:
Hinreaktion durch Energiezufuhr aus UV-Licht hν und Rückreaktion durch Temperaturerhöhung Δ
Die Rückreaktion ist in Gegenwart von Metallkomplexkatalysatoren wie Metall-Porphyrinen bei Temperaturen über 100 °C möglich.[7]
Speicherung von Sonnenenergie
Durch die Isomerisierung von Norbornadien zu Quadricyclan wird eine Energie von ΔH = −89 kJ/mol 'gespeichert'. Das System kann also potentiell als Speicher für Solarenergie genutzt werden.[8][9] Da die Hauptabsorption dieser Reaktion bei rund 300 nm liegt, aber nur geringe Anteile des Sonnenlichts unter 400 nm liegen, ist dieser Einsatz aber begrenzt.
Reaktionen
Quadricyclan reagiert glatt mit Essigsäure zu einer Mischung von Nortricyclylacetat und exo-Norbornylacetat.[4] Ähnlich wie Cyclopropan geht Quadricyclan Additionsreaktionen ein, z. B. auch mit Brom oder Wasserstoff. Dabei entstehen Norbornen- oder Norbornadienderivate.[10] Es reagiert auch mit vielen Dienophilen zu 1:1-Addukten.[1]
Literatur
- E. J. Wucherer, Angelica Wilson: Chemical, Physical and Hazards Properties of Quadricyclane, Air Force Research Laboratory, Edwards Air Force Base CA 93524-7048, März 1998 (PDF).
- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 390.
- Streitwieser / Heathcock: Organische Chemie, 1. Auflage, Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8, S. 1351–1352.
Einzelnachweise
- ↑ a b Claibourne D. Smith: Quadricyclane In: Organic Syntheses. 51, 1971, S. 133, doi:10.15227/orgsyn.051.0133; Coll. Vol. 6, 1988, S. 962 (PDF).
- ↑ a b c Exciton: QUADRICYCLANE Datasheet
- ↑ a b Datenblatt Quadricyclane, 99% bei Sigma-Aldrich, abgerufen am 18. März 2014 (PDF).
- ↑ a b Petrov, V. A; Vasil’ev, N. V. „Synthetic Chemistry of Quadricyclane“ Current Organic Synthesis (2006) 3, S. 215–259 (Abstract).
- ↑ P S Kalsi: Organic Reactions And Their Mechanisms. New Age International, 2000, ISBN 978-8-122-41268-0, S. 366 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patentanmeldung US20040054244: Process of quadricyclane production. Angemeldet am 12. September 2003, veröffentlicht am 18. März 2004, Anmelder: Paul Cahill, Richard Steppel, Erfinder: Exciton.
- ↑ a b Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente - Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer. John Wiley & Sons, 2012, ISBN 3-527-66088-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dubonosov, A. D; Bren, V. A; Chernoivanov, V. A. „Norbornadiene – quadricyclane as an abiotic system for the storage of solar energy.“ Russ. Chem. Rev. (Engl. Transl.) 71 (2002): S. 917–927.
- ↑ Constantine Philippopoulos, Dimitrios Economou, Constantine Economou, John Marangozis: Norbornadiene-Quadricyclane System in the Photochemical Conversion and Storage of Solar Energy. In: Ind. Eng. Chem. Res.. 22, Nr. 4, 1983, S. 627. doi:10.1021/i300012a021.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Koordinatoren): Lexikon der Chemie in drei Bänden, Spektrum Verlag, Heidelberg, Band 3, 1999, ISBN 3-8274-0381-2, S. 131.

