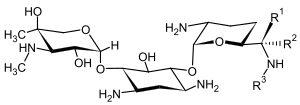
Gentamicin
| Allgemeines | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Freiname | Gentamicin | ||||||||||||||||||
| Andere Namen |
Gentamycin | ||||||||||||||||||
| Summenformel | Stoffgemisch | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | Stoffgemisch | ||||||||||||||||||
| Schmelzpunkt |
218–237 °C (Gentamicinsulfat)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gentamicin ist ein Aminoglycosidantibiotikum, das als Arzneistoff in Form seines Sulfatsalzes bei bakteriellen Infektionen eingesetzt wird. Der Arzneistoff setzt sich aus mehreren Einzelverbindungen der Stoffgruppe der Gentamicine zusammen.
Geschichte
Die ersten Gentamicine wurden von Mitarbeitern von Schering in New Jersey im Jahr 1963 in den Produkten des Bakterienstamms Micromonospora purpurea entdeckt und deren antibakterielle Wirkung erkannt.[4]
Zusammensetzung
Das Gentamicin, wie es von dem Bakterium Micromonospora purpurea gebildet wird, ist ein Gemisch strukturell sehr ähnlicher Aminoglykosidverbindungen, den Gentamicinen. Der pharmazeutisch genutzte Wirkstoff enthält fast ausschließlich Gentamicine vom Typ C. Es handelt sich um ein Gemisch, das zu 25–45 % aus Gentamicin C1, zu 10–30 % aus Gentamicin C1a und zu 35–55 % aus Gentamicin C2, C2a und C2b besteht. Erste gentamicinsulfathaltige Arzneimittel kamen in Deutschland in den Jahren 1960–1970 unter dem Handelsnamen Refobacin auf den Markt.
| ||||||||||||||||||||||||||||||||||||||||
Pharmakologie
Gentamicin wird zur antimikrobiellen Therapie verschiedenster bakterieller Infektionen eingesetzt und ist gut wirksam. Jedoch wird es aufgrund seiner erheblichen Nebenwirkungen an Niere und Innenohr in der Humanmedizin nur noch als Notfallmedikament für schwere bakterielle Infekte, insbesondere für nosokomiale Infektionen, eingesetzt. Besonders häufig wird Gentamicin als Notfallantibiotikum in der Pädiatrie verwendet. Die WHO empfiehlt Gentamicin als Teil der Medikation gegen multipel resistente Tuberkulosebakterien.[5]
In der Veterinärmedizin wird es wegen der guten Wirksamkeit und des relativ niedrigen Preises ebenfalls häufig verwendet.
Die Nebenwirkungen wie Ohren- und Nierenschäden (Oto- und Nephrotoxizität) fallen bei topischer (lokaler) Anwendung nicht ins Gewicht, weswegen es hauptsächlich in Form von Augentropfen und Augen- und Hautsalben eingesetzt wird.
Anwendungsgebiete
Parenterale Behandlung
Gentamicin wird zur parenteralen Behandlung akut lebensbedrohlicher septischer Infektionen, insbesondere nosokomialer Infektionen, in Kombination mit β-Lactam-Antibiotika eingesetzt. Aminoglykoside sind nach wie vor unverzichtbare Antibiotika bei Endokarditis und schweren Infektionen durch Pseudomonas. Sie besitzen auch Bedeutung bei der Behandlung von Mykobakteriosen sowie bei schweren Infektionen durch Enterokokken, Listerien, Staphylokokken und Enterobakterien. Der Nutzen einer längeren Behandlungsdauer muss sehr streng gegen die Gefahr potentieller Toxizität abgewogen werden (das Risiko für toxische Wirkungen nimmt mit der Behandlungsdauer deutlich zu). Jedes Aminoglykosid, so auch Gentamicin, kann – in Abhängigkeit von Dosierung, Therapiedauer, Grundleiden des Patienten und Begleitmedikationen – zu nephro- und ototoxischen Nebenwirkungen führen. Die parenterale Gabe von Gentamicinsulfat kann als intramuskuläre oder langsame intravenöse Injektion oder als Kurzinfusion in ein bis drei Dosen pro Tag erfolgen. Kinder, Jugendliche und Erwachsene werden initial mit 3 bis 5 mg/kg Körpergewicht pro Tag behandelt. Die tägliche Einmalgabe der gesamten Tagesdosis in Form einer Infusion über 60 Minuten gilt heute als Standard. Die parenterale Therapie sollte 10–14 Tage nicht überschreiten.[6]
Lokaltherapie in der Augenheilkunde
Gentamicin wird zur Behandlung von Infektionen der vorderen Augenabschnitte eingesetzt.
Chirurgie/Orthopädie
Für die Behandlung postoperativer bzw. posttraumatischer Weichteil- und Knocheninfektionen stehen gentamicinsulfathaltige implantierbare Kugelketten und Knochenzement zur Verfügung. Wegen der hohen Hitzeresistenz und der geringen allergenen Potenz wird vor allem Gentamicin in Trägermaterialien eingebracht, z. B. in sogenannte Knochenzemente (Gentamicin-PMMA-Kugeln u. a.). In Problemsituationen der Knochenchirurgie haben sich diese Materialien bewährt. Weiterhin werden gentamicinhaltige Kollagenschwämme bei verschiedenen Eingriffen verwendet, die resorbierbar sind und neben dem antibiotischen Effekt auch eine blutstillende Wirkung besitzen.
Im Off-Label-Use wird Gentamicinsulfat zur Behandlung des Morbus Menière eingesetzt.[7] Dabei wird die schädliche Wirkung des Gentamicins auf die Sinneszellen des Innenohrs (Ototoxizität) ausgenutzt, um die Sinneszellen zu zerstören und die durch die Erkrankung ausgelösten Schwindelanfälle zu mildern.
Wirkungsmechanismus
Das Aminoglykosid-Antibiotikum Gentamicin behindert das Ablesen der mRNA an den Ribosomen durch Bindung an die 30S-Untereinheit. So wird die Proteinbiosynthese der Bakterien gebremst.
In hoher Konzentration beeinflusst der Stoff auch die Proteinsynthese menschlicher Zellen: dort, wo in der mRNA ein Stoppsignal für das Ende der Proteinsynthese codiert, wird dieses Signal überlesen. Die Proteinsynthese läuft solange weiter, bis das nächste Stoppsignal auftritt. Das Überlesen erfolgt nicht immer, aber in wenigen Prozent der Fälle.
Gentamicin ist bakterizid und teilweise nur schlecht gewebegängig.
Wirksamkeit
Gentamicin wirkt vor allem bei gramnegativen Erregern:
- Haemophilus influenzae
- Shigella sp.
- Escherichia coli
- Enterobacter
- Klebsiella
- Proteus
- Pseudomonas aeruginosa
- Citrobacter
- Serratia
- Yersinia enterocolitica
Bei grampositiven Erregern kaum:
- Staphylococcus aureus
- Staphylococcus epidermidis (nur 30–60 % empfindlich)
Es ist unwirksam
- bei viralen Infektionen und
- bei Pilzinfektionen sowie
- bei Infektionen durch anaerobe Bakterien, da die Aufnahme von Aminoglykosiden in die Bakterienzelle sauerstoffabhängig ist.
- auch von den oben genannten Erregern sind nicht alle Isolate automatisch empfindlich! Es empfiehlt sich im Zweifelsfall die Testung.
In sauren und/oder anaeroben Milieu ist die Wirkung von Gentamicin reduziert.[8]
Unerwünschte Wirkungen
Die therapeutische Breite von Gentamicin ist gering. Steigen die Plasmakonzentrationen (durch Überdosierung oder bei Kumulation bei Nierenfunktionseinschränkung) über den kritischen Spiegel, so nimmt das Risiko für nephrotoxische Reaktionen und für irreversible Innenohrschäden (Ertaubung) des Patienten gefährlich zu. Ausschlaggebend für das Risiko unerwünschter Nebenwirkungen sind die „Talspiegel“ und vor allem die Dauer der Behandlung, da es zu einer kontinuierlichen Anreicherung in der Nierenrinde kommt. Gentamicin, wie alle Aminoglykoside, kann nicht durch passive Diffusion, sondern nur durch aktiven Transport in eine Zelle gelangen. Es handelt sich hierbei um einen Sättigungsprozess. Bei Überschreiten der Sättigungskonzentration wird das Antibiotikum nicht vermehrt aufgenommen. Dadurch erklärt sich, dass eine einmalige hohe Konzentration am Zielort der Toxizität geringere Wirkungen verursacht als ein langdauernder Kontakt mit niedrigen Konzentrationen. Da Gentamicin nur sehr langsam aus den Tubuluszellen eliminiert wird, besteht bei vorangegangener Aminoglykosid-Therapie (innerhalb von sechs Wochen) ein erhöhtes Risiko für toxische Wirkungen. Geringe Mengen des Antibiotikums werden noch wochenlang nach Abschluss einer Therapie aus den „tiefen Kompartimenten“ (z. B. proximale Tubuluszellen) freigesetzt.
Wegen der möglichen schweren Nebenwirkungen ist eine strenge Indikationsstellung und Dosierung nach der Nierenfunktion (Creatinin-Clearance) bei der Therapie mit Gentamicin geboten.
Unerwünschte Wirkungen betreffen besonders die Niere und das Ohr.
Nephrotoxizität
In 1–10 % der Fälle tritt ein meist reversibler proximaler Tubulusschaden auf.[9][10] Gentamicin wird in die proximalen Tubuluszellen eingeschleust und akkumuliert in den dortigen Lysosomen. Die aminoglykosidinduzierte (meist reversible) Nierenfunktionseinschränkung verlangsamt die weitere Antibiotikaausscheidung. Die Kombination von Gentamicin mit anderen Pharmaka mit nephrotoxischer Komponente wie Furosemid, bestimmten Immunsuppressiva, bestimmten Antibiotika etc., verstärkt die Nierenschädigung. Eine Verwendung von Statinen zur Minderung der Nephrotoxizität wird untersucht.[11]
Ototoxizität
In 1–3 % der Fälle tritt ein Hörschaden auf.[9] Am Innenohr führt schon ein geringer Übertritt von Gentamicin in die Haarzellen zum irreversiblen Verlust der Sinneshärchen. Es kommt zu Gleichgewichtsstörungen und zum im Hochtonbereich beginnenden Hörverlust. Gleichgewichtsstörungen können in bis zu 14 % der Fälle auftreten.[12] Die selektiv die Haarzellen des Innenohrs betreffende Toxizität könnte dadurch erklärt werden, dass zwischen Endolymphe und dem Inneren der Haarzellen eine weit höhere Potentialdifferenz (> −150 mV) besteht als an den Membranen anderer Körperzellen (zwischen −55 und −100 mV). Diese elektrophysiologische Besonderheit könnte begünstigen, dass Gentamicin – bei längerfristig hohen Plasmakonzentrationen – vorrangig ins Haarzell-Cytoplasma eingeschleust wird. Hörstörungen beginnen mit einer Verminderung der Hörschärfe im Hochtonbereich und sind zumeist irreversibel. Wichtigster Risikofaktor ist eine vorbestehende Niereninsuffizienz. Das Risiko steigt proportional mit der Höhe der Gesamt- und Tagesdosis.[13]
Für die ototoxische Wirkung durch Aminoglykoside gibt es teilweise eine genetische Veranlagung. Bisher sind zwei Mutationen im mitochondrialen Erbgut bekannt, die zu einem hohen Risiko für eine Aminoglykosid bedingte Ototoxizität führen:
Es wird geschätzt, dass etwa 15 % aller Aminoglykosid-induzierten Ertaubungsfälle in den USA auf die A1555G-Mutation zurückzuführen sind. In China liegt der Anteil bei mindestens 30 %. Über die Häufigkeit der Delta-T961Cn-Mutation ist derzeit nichts bekannt. Aktuelle Daten aus Deutschland existieren nicht. Es wird geraten, bei jedem Aminoglykosid-induzierten Ertaubungsfall den Patienten hinsichtlich der beiden obengenannten Mutationen zu untersuchen und im „positiven“ Fall alle weiblichen Verwandten hinsichtlich eines erhöhten Risikos für Aminoglykoside zu beraten.[15]
In einer kürzlich publizierten retrospektiven Studie an 33 erwachsenen Patienten wurde gezeigt, dass es keine sichere Gentamicindosis gibt. In dieser Studie war das Messen der Gentamicin-Serumspiegel ohne Vorhersagewert für den Beginn, das Auftreten oder die Schwere der Ototoxizität.[16] Manche Autoren verlangen auf Grund der Schwere und Häufigkeit der Nebenwirkungen und der zugleich vorhandenen guten Alternativmedikamente, auf die Anwendung von Gentamicin zu verzichten.[17]
Eine randomisierte kontrollierte Studie zeigt, dass sich die Gefahr eines permanenten Hörschadens durch die gleichzeitige Gabe von Acetylsalicylsäure (ASS) deutlich senken lässt. Die Studie, welche zwischen 1999 und 2003 an zwei Kliniken in China durchgeführt wurde, zeigt zunächst, wie stark ototoxisch Gentamicin ist: 14 von 106 Patienten (etwa 13 %), die zur Behandlung von akuten Infektionen intravenös mit Gentamicin (zweimal täglich 80 bis 160 mg über 5 bis 7 Tage) behandelt wurden, erlitten eine Minderung der Hörschwelle um 15 dB oder mehr auf einem oder beiden Ohren. In einer Vergleichsgruppe von 89 Patienten, welche zusätzlich zur Gentamicinmedikation täglich 3-mal 1 Gramm ASS über 14 Tage einnahmen, traten dagegen nur bei 3 Patienten (etwa 3 %) Hörstörungen auf. Nach Ansicht der Autoren begründen diese Ergebnisse daher den regelmäßigen Einsatz von ASS als Zusatz zu Gentamicin, zumal es zu keinem Wirkungsverlust des Antibiotikums gekommen war.[18][19]
Neuromuskuläre Blockaden
Durch lokale Anwendung konzentrierter Aminoglykosid-Lösungen können neuromuskuläre Blockaden provoziert werden, z. B. anlässlich von Herzklappen-Operationen.
Vorsichtsmaßnahmen
Um dem Auftreten schwerer Nebenwirkungen durch Gentamicin, wie sie bei systemischer Gabe auftreten können, entgegenzutreten, sind kritische Plasmaspiegel zu vermeiden, etwa durch intramuskuläre Injektion oder langsame Infusion. Die kontinuierliche Überwachung der Nierenfunktion (Bestimmung von Serumkreatinin oder Kreatinin-Clearance vor, während und nach der Behandlung) ist empfohlen; gegebenenfalls sind die Blutspiegel zu überwachen, insbesondere bei Störungen der Nierenfunktion, bei Dialyse-Patienten, bei Langzeittherapie, bei Hochdosisbehandlung, z. B. bei Immundefizienz.[6]
Handelsnamen
Garamycin (CH), Gentamycin (D), Gencin (D), Gentamytrex (D), Gentax (A), Gent-Ophtal (D), Ophtagram (CH), Refobacin (D, A), Septopal (CH), Sulmycin (D), diverse Generika (D, A)
Cibaflam (D), Decoderm comp (D, A), Dexa-Gentamicin (D), Dexagent (D), Dexagenta (A), Dexamytrex (D), Diprogenta (D, A, CH), Infectoflam (CH), Inflanegent (D), Ophtasone (CH), Septopal (D, A), Sulmycin (A), Terracortril (D), Triderm (CH), Voltamicin (CH)
Weblinks
Einzelnachweise
- ↑ a b c d e Eintrag zu Gentamicin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. März 2011.
- ↑ a b Datenblatt Gentamicin sulfate bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- ↑ Eintrag zu Gentamicin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ Gentamicin. In: Br Med J. Band 1, Nr. 5533, Januar 1967, S. 158–159, PMID 6015651, PMC 1840594 (freier Volltext).
- ↑ S.-H. Sha, J.-H. Qiu, J. Schacht: Aspirin to Prevent Gentamicin-Induced Hearing Loss. In: NEJM. 354, 2006, S. 1856–1857.
- ↑ a b W. Forth, D. Henschler, W. Rummel, U. Förstermann, K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 8. Auflage. Urban & Fischer, 2001, S. 828–835.
- ↑ Helmut Schaaf: Morbus Menière Schwindel - Hörverlust - Tinnitus : eine psychosomatisch orientierte Darstellung. 9., vollständig überarbeitete Auflage. Berlin 2022, ISBN 978-3-662-64213-9.
- ↑ Klaus Aktories, U. Förstermann, F. Hofmann, Klaus Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, 2004, S. 813.
- ↑ a b D. Schneider: Checkliste Arzneimittel A–Z. 2. Auflage. Thieme, 2004, S. 354–355.
- ↑ A. Jamshidzadeh, R. Heidari, S. Mohammadi-Samani, N. Azarpira, A. Najbi, P. Jahani, N. Abdoli: A comparison between the nephrotoxic profile of gentamicin and gentamicin nanoparticles in mice. In: Journal of Biochemical and Molecular Toxicology. Band 29, Nummer 2, Februar 2015, S. 57–62, doi:10.1002/jbt.21667. PMID 25293820.
- ↑ S. Dashti-Khavidaki, A. Moghaddas, B. Heydari, H. Khalili, M. Lessan-Pezeshki, M. Lessan-Pezeshki: Statins against drug-induced nephrotoxicity. In: Journal of Pharmacy & Pharmaceutical Sciences. Band 16, Nummer 4, 2013, S. 588–608. PMID 24210066.
- ↑ P. J. Govaerts u. a.: Aminoglycoside-induced ototoxicity. In: Toxicology Letters. Band 52, Nr. 3, 1990, S. 227–251.
- ↑ Fachinformation Gentamicin (B. Braun).
- ↑ Y. Qian, M. X. Guan: Interaction of aminoglycosides with human mitochondrial 12S rRNA carrying the deafness-associated mutation. In: Antimicrobial Agents and Chemotherapy. Band 53, Nummer 11, November 2009, S. 4612–4618, doi:10.1128/AAC.00965-08. PMID 19687236, PMC 2772318 (freier Volltext).
- ↑ N. Fischel-Ghodsian: Mitochondrial deafness renewed. In: Human Mutation. 13, 1999, S. 261–270.
- ↑ F. Owen Black u. a.: Permanent Gentamicin Vestibulotoxicity. In: Otology & Neurology. 25, 2004, S. 559–569.
- ↑ P. William: Should Aminoglycoside Antibiotics Be Abandoned? In: The American Journal of Surgery. 180(6), 2001, S. 512–516.
- ↑ S.-H. Sha, J.-H. Qiu, J. Schacht: Aspirin to Prevent Gentamicin-Induced Hearing Loss. In: NEJM 354, 2006, S. 1856–1857.
- ↑ J. Lautermann, J. Schacht, K. Jahnke: Aminoglykosidototoxixität – Pathomechanismen, Klinik und Präventionsmöglichkeiten. In: HNO. 51, 2003, S. 344–352; doi:10.1007/s00106-003-0830-1.