Riboflavin
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
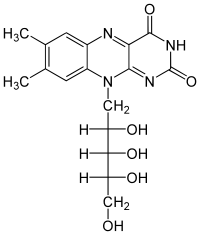
| |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin B2 | ||||||||
| Andere Namen | |||||||||
| Summenformel | C17H20N4O6 | ||||||||
| CAS-Nummer | 83-88-5 | ||||||||
| PubChem | 1072 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB00140 | ||||||||
| Kurzbeschreibung | bitter schmeckender, gelb bis orangefarbener Feststoff[4] | ||||||||
| Vorkommen | Leber, Hefe, Weizenkeime | ||||||||
| Physiologie | |||||||||
| Funktion | Vorstufe für Flavin-Coenzyme (FAD, FMN) | ||||||||
| Täglicher Bedarf | 1,5–1,7 mg | ||||||||
| Folgen bei Mangel | Entzündungen der Haut (Exantheme, Hautrisse), Störungen des Wachstums, der Blutbildung und neurologischer Art | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 376,37 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Riboflavin, auch Lactoflavin oder Vitamin B2, frühere Bezeichnung Vitamin G, ist ein Vitamin aus dem B-Komplex. Es wird umgangssprachlich auch Wachstumsvitamin genannt.
Geschichte
Vitamin B2 wurde 1920 erstmals aus Milch (lacto) isoliert, enthält ein gelbes Chromophor (flavin) und einen Ribityl-Rest (ribo).[6]
Vorkommen
Vitamin B2 kann in der Nahrung als ungebundenes Riboflavin vorliegen oder an Eiweiße gebunden. Es kommt unter anderem in Milch und Milchprodukten, aber auch in Gemüse wie Broccoli, Spargel oder Spinat vor, außerdem in Fisch, Muskelfleisch, Eiern und Vollkornprodukten.
Es wird seit 1990 biotechnologisch mit Hilfe des filamentösen Pilzes Ashbya gossypii hergestellt. Der Wildtyp produziert bis zu 100 mg Riboflavin pro g Biomasse, die Produktionsstämme liefern mehr als 20 g/L. Alternativ wird Riboflavin auch durch gentechnisch veränderte Stämme von Bacillus subtilis produziert.[7]
Eigenschaften
Riboflavin ist ein Derivat des Heterozyklus Isoalloxazins und des Zuckeralkohols Ribitol. Riboflavin zählt – obwohl wenig in Wasser löslich – zu den wasserlöslichen Vitaminen; es ist lichtempfindlich, aber so stabil gegen Hitze und Sauerstoff[4], dass es beim Kochen nicht zerstört wird.
Organische Synthese
Die organische Synthese wird ausgehend von D-Ribose gestartet. Alternativ kann auch D-Glucose verwendet werden. Dabei wird die D-Glucose über Oxidation, Epimerisierung der Hydroxygruppen und anschließender Reduzierungen zu D-Ribose umgewandelt.
Die D-Ribose wird mit 3,4-Xylidin bei 50–80 °C in Methanol gelöst. Dabei wird Wasserstoff unter einem Druck von 3 bar an einen Palladium-Kohle-Katalysator zugeströmt, wodurch der doppelt gebundene Sauerstoff zwei Wasserstoffatome aufnehmen kann und sich somit Wasser aus der Verbindung abspalten kann. Diese Abspaltung ist die Triebkraft für die Bildung des Zwischenprodukts N-D-Ribityl-3,4-xylidin.
Dieses Zwischenprodukt wird im Folgenden mit einem Anilinderivat, zum Beispiel Phenyldiazoniumchlorid, in Essigsäure gegeben, wobei sich 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol bildet. Diese elektrophile aromatische Substitutionsreaktion, bei der das Diazoniumsalz mit dem aktivierten Aromaten reagiert, wird Azokupplung genannt. Dabei wird das positiv geladene Stickstoffatom des Diazoniumsalzes von der ortho-Position des N-D-Ribityl-3,4-xylidins angegriffen, wobei unter Abspaltung von Chlorwasserstoffsäure 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol entsteht.
Zuletzt wird das 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol in Eisessigsäure und Dioxan gelöst und Barbitursäure zugegeben. Ein doppelt gebundener Sauerstoff der Barbitursäure wird dabei Protonen aufnehmen und unter der Abspaltung von Wasser (Kondensationsreaktion) das Ringsystem öffnen. Das Intermediat bindet dann an das 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol, wobei es unter Abspaltung von Anilin einen intramolekularen Ringschluss vollzieht.
Das entstandene Produkt wird Riboflavin genannt und kann anschließend aufgereinigt werden.[8]
Funktion
Riboflavin dient als Vorstufe für Flavin-Koenzyme (FAD, FMN), die insbesondere in Oxidoreduktasen, z. B. NADH-Dehydrogenase, eine große Rolle spielen. Dadurch nimmt es im Stoffwechsel eine zentrale Rolle ein.
Der angeblichen Empfehlung von Neurologen zu einer Tablette zu 100 mg bzw. 400 mg Riboflavin[9][10] am Tag zur Prophylaxe gegen Migräne steht die Einschätzung einer S3-Leitlinie gegenüber, dass von einem Hinweis, aber nicht von einem Nachweis der Wirksamkeit von Riboflavin (Vitamin B2) zur Migräneprophylaxe gesprochen werden kann.[11]
Tagesbedarf
Der tägliche Bedarf beträgt etwa 1,5 mg und wird üblicherweise durch die normale Nahrungsaufnahme gedeckt.
- Säuglinge: 0,3–0,4 mg[4]
- Kinder und Jugendliche (bis 15 Jahre): 0,7–1,6 mg[4]
- Jugendliche (ab 15 Jahre) und Erwachsene: 1,2–1,5 mg[4]
- Schwangere: 1,5 mg[4]
- Stillende: 1,6 mg[4]
Mangelerscheinungen
Bei normaler Ernährung treten keine Mangelerscheinungen auf. Allerdings kann es bei Schwangeren und Alkoholkranken zu Mangelerscheinungen kommen, die sich in Exanthemen, Hautrissen (insbesondere an den Lippen bzw. im Mundwinkel, Cheilosis) und Lichtüberempfindlichkeit äußern. Diese Hypovitaminose heißt Ariboflavinose oder B2-Avitaminose.[12] Zur Früherkennung eines Riboflavin-Mangels kann der EGRAC bestimmt werden.
Akuter Riboflavin-Mangel betrifft auch Menschen, die unter dem Brown-Vialetto-van-Laere-Syndrom leiden, da der Riboflavin-Transport bei ihnen durch einen Gendefekt gestört ist.[13]
In der Migräne-Forschung wird vermutet, dass Migräne-Patienten an einer Unterversorgung des Hirnstoffwechsels mit Riboflavin leiden können, der durch die Zuführung von entsprechend mehr Vitamin behoben oder gelindert werden kann.
Überdosierung
Überdosierungen sind beim Menschen nicht bekannt. Die Toxizität von B2 ist sehr gering. Für gewöhnlich wird, wie bei anderen wasserlöslichen Vitaminen auch, vom Körper nicht benötigtes bzw. resorbierbares Riboflavin mit dem Urin bzw. Stuhl wieder ausgeschieden.
Sonstige Nutzung
Das wasserlösliche, hitzestabile und lichtempfindliche Riboflavin wurde 1962 als einer der ersten Lebensmittelzusatzstoffe durch die Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in der EWG zugelassen und erhielt die E-Nummer E 101. Auch in der aktuellen Verordnung (EG) Nr. 1333/2008 wird es aufgeführt und ist dadurch in der EU und den anderen Ländern des EWR als Lebensmittelfarbstoff zugelassen. In der Verordnung wird auch geregelt, dass eine Verwendung nur in bestimmten Lebensmitteln zulässig ist. Riboflavin darf dabei ohne Mengebegrenzung (quantum satis) verwendet werden. In der Schweiz ist die Verwendung sinngemäß durch die Zusatzstoffverordnung geregelt.[14]
Es wird auch gerne zur Kontrolle von Reinigungsprozessen (Flächen, Hände etc.) in der Pharmaindustrie eingesetzt, da es auch in geringer Konzentration bei UV-Licht leuchtet und damit gut sichtbar ist.
In der Medizin kann Riboflavin auch als Photosensibilisator eingesetzt werden. So wird es beispielsweise zur Quervernetzung von Kollagen in der menschlichen Hornhaut verwendet, was als Behandlung von Keratokonus dienen kann.[15]
Einzelnachweise
- ↑ Eintrag zu E 101: Riboflavins in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- ↑ Eintrag zu RIBOFLAVIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021
- ↑ Eintrag zu LACTOFLAVIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i Eintrag zu Riboflavin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- ↑ a b c d Eintrag zu Riboflavin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juni 2017. (JavaScript erforderlich)
- ↑ D. Steinhilber, M. Schubert-Zsilavecz, H. J. Roth: Medizinische Chemie – Targets und Arzneistoffe. Deutscher Apotheker Verlag, Stuttgart 2005, ISBN 3-7692-3483-9.
- ↑ H. Sahm, G. Antanikian, K-P. Stahmann, R. Takors: Industrielle Mikrobiologie. 1. Auflage. Springer Spektrum, Berlin/Heidelberg 2013, ISBN 978-3-8274-3039-7.
- ↑ K. -P. Stahmann, J. L. Revuelta, H. Seulberger: Three biotechnical processes using Ashbya gossypii, Candida famata, or Bacillus subtilis compete with chemical riboflavin production. In: Applied Microbiology and Biotechnology. Band 53, Nr. 5, 15. Mai 2000, ISSN 0175-7598, S. 509–516, doi:10.1007/s002530051649 (springer.com [abgerufen am 26. Februar 2021]).
- ↑ J. Schoenen, J. Jacquy, M. Lenaerts: Effectiveness of high-dose riboflavin in migraine prophylaxis. A randomized controlled trial. In: Neurology. Band 50, Nummer 2, Februar 1998, S. 466–470, PMID 9484373.
- ↑ C. Boehnke, U. Reuter, U. Flach, S. Schuh-Hofer, K. M. Einhäupl, G. Arnold: High-dose riboflavin treatment is efficacious in migraine prophylaxis: an open study in a tertiary care centre. In: European journal of neurology. Band 11, Nummer 7, Juli 2004, S. 475–477, doi:10.1111/j.1468-1331.2004.00813.x, PMID 15257686.
- ↑ G. Haag, H.-C. Diener, A. May, C. Meyer, H. Morck, A. Straube, P. Wessely, S. Evers: Selbstmedikation bei Migräne und beim Kopfschmerz vom Spannungstyp. Evidenzbasierte Empfehlungen der Deutschen Migräne- und Kopfschmerzgesellschaft (DMKG), der Deutschen Gesellschaft für Neurologie (DGN), der Österreichischen Kopfschmerzgesellschaft (ÖKSG) und der Schweizerischen Kopfwehgesellschaft (SKG). (PDF; 341 kB). Deutsche Migräne- und Kopfschmerz-Gesellschaft, S3-Leitlinie, Schattauer-Verlag, 2009, S. 394.
- ↑ Ludwig Weissbecker: B2-Avitaminose (Ariboflavinose). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1092 f.
- ↑ Annet M Bosch, Kevin Stroek, Nico G Abeling, Hans R Waterham, Lodewijk IJlst: The Brown-Vialetto-Van Laere and Fazio Londe syndrome revisited: natural history, genetics, treatment and future perspectives. In: Orphanet Journal of Rare Diseases. Band 7, Nr. 1, 2012, ISSN 1750-1172, S. 83, doi:10.1186/1750-1172-7-83 (biomedcentral.com [abgerufen am 26. Februar 2021]).
- ↑ Verordnung des EDI über die zulässigen Zusatzstoffe in Lebensmitteln. (PDF) Das Eidgenössische Departement des Innern (EDI), 1. Juli 2020, abgerufen am 23. Januar 2022.
- ↑ Frederik Raiskup, Eberhard Spoerl: Corneal Crosslinking with Riboflavin and Ultraviolet A. I. Principles. In: The Ocular Surface. Band 11, Nr. 2, April 2013, S. 65–74, doi:10.1016/j.jtos.2013.01.002 (elsevier.com [abgerufen am 26. Februar 2021]).
Weblinks
- Höchstmengen für Vitamin B1, Vitamin B2 und Pantothensäure in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
