Tetraschwefeltetranitrid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Tetraschwefeltetranitrid | ||||||
| Summenformel | S4N4 | ||||||
| Kurzbeschreibung | |||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 184,287 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Dichte |
2,22 g·cm−3[2] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
185 °C[2] | ||||||
| Löslichkeit |
nahezu unlöslich in Wasser,[1] löslich in Schwefelkohlenstoff[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Tetraschwefeltetranitrid ist eine anorganische chemische Verbindung des Schwefels aus der Gruppe der kovalenten Nitride. Die Verbindung gehört neben dem Pentaschwefelhexanitrid, dem Tetraschwefeldinitrid, dem Dischwefeldinitrid, dem Monoschwefelmononitrid, den Oligoschwefeldinitriden und dem polymeren Polythiazyl (SN)x zur Gruppe der Schwefel-Stickstoff-Verbindungen oder Schwefelnitride.
Geschichte
Die Verbindung wurde in verunreinigter Form erstmals 1835 von M. Gregory durch die Umsetzung von Dischwefeldichlorid mit Ammoniak hergestellt.[4] Die Stöchiometrie konnte erst 1850 angegeben werden.[5] Die tetramere Natur wurde 1896 von R. Schenck erkannt.[6] Die molekulare Struktur als achtgliedriger Ring wurde 1936 vorgeschlagen[7][8] und ab 1947 von M. Goehring bestätigt.[9][10] Mittels Röntgenbeugungsmessungen wurde 1952 und 1963 die gewinkelte Struktur des Achtrings als Käfigverbindung charakterisiert.[11][12] Tetraschwefeltetranitrid ist somit eine der am längsten bekannten Käfigverbindungen.
Gewinnung und Darstellung
Tetraschwefeltetranitrid kann durch Reaktion von Schwefel mit flüssigem Ammoniak in Gegenwart von Silbernitrat hergestellt werden. Die zugesetzten Silberionen dienen dabei dem Abfangen des gebildeten Schwefelwasserstoffs als Silbersulfid und Verschiebung des Gleichgewichts auf die Produktseite.[1]
Eine Reihe von Synthesevarianten gehen von Dischwefeldichlorid aus. So kann die Verbindung durch die Reaktion mit Ammoniak in Dichlormethan und anschließender Umkristallisation in Toluol gewonnen werden.[13]
Besser gelingt die Synthese in mit Chlor gesättigten Tetrachlormethan oder Dichlormethan bei 20–50 °C oder mit Ammoniumchlorid ohne Lösungsmittel bei 150–160 °C. Hier treten in der Synthesesequenz verschiedene Schwefelnitridchloride wie das Thiazylchlorid ClSN sowie S3N2Cl2, S4N3Cl und S3N3Cl3 auf.[1]
Eine weitere Synthese geht vom Schwefeltetrachlorid aus, das aus Schwefeldichlorid und Sulfurylchlorid hergestellt mit einem substituierten Diaminosulfan umgesetzt wird. Das Kürzel “Me” steht hierbei für eine Methylgruppe.[1]
Eigenschaften
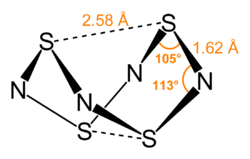
Tetraschwefeltetranitrid ist eine Käfigverbindung, deren Struktur einer D2d-Symmetrie entspricht. Die Struktur kann als ein Tetraeder aus elektropositiven Schwefelatomen gesehen werden, das durch ein Quadrat aus elektronegativen Stickstoffatomen durchdrungen wird.[1][13] Alle S-N-Bindungen sind mit 162 pm gleich lang, so dass auf Mehrfachbindungen mit delokalisierten π-Elektronen geschlossen werden kann. Zusätzlich enthält die geschlossene Käfigstruktur zwei schwache S-S-Bindungen mit einer Bindungslänge von 258 pm. Diese Bindungslänge ist wesentlich länger als die der Einfachbindungen im S8-Molekül mit 205 pm, aber wesentlich kürzer als die eines Van der Waals-Abstands mit 360 pm.[14] Die Verbindung ist thermochrom, was bedeutet, dass sie ihre Farbe von farblos (bei 77 K), über leuchtend orange (bei 298 K) zu rot (bei 373 K) ändert.[13] Tetraschwefeltetranitrid sublimiert unterhalb von 130 °C bei 0,1 mbar Druck. In Wasser ist es unlöslich. Festes Tetraschwefeltetranitrid zerfällt bei Erhitzung über 130 °C oder bei Stoßeinwirkung explosionsartig in seine Elemente, wobei eine Zersetzungswärme von −460 kJ/mol realisiert wird.[1]
Gasförmiges Tetraschwefeltetranitrid zersetzt sich oberhalb von 200 °C hauptsächlich in das ringförmige Dimer Dischwefeldinitrid, wobei sich auch S3N3 und S4N2 bilden.[15] Oberhalb von 300 °C zerfällt es in die Elemente und Schwefelmononitrid SN.[1] Die Hydrolyse in stark basischem Medium ergibt Ammoniak, Thiosulfat und Sulfit.[1]
In schwach basischen Medium wird Trithionat , Ammoniak und Sulfit gebildet. Organische Basen spalten den S4N4-Ring nicht vollständig. Bei der Umsetzung mit Grignard-Verbindungen RMgBr wird das Produkt (R = Aryl) oder mit Trimethylsilyldimethylamin eine Additionsverbindung erhalten.[1]
Mit starken Säuren wie Tetrafluoroborsäure erfolgt eine Protonierung an einem Stickstoffatom unter Salzbildung.[1]
Die Verbindung bildet mit Lewis-Säuren Additionsverbindungen wie z. B. Antimonpentachlorid als S4N4·SbCl5, mit Titantetrachlorid als S4N4·TiCl4, mit Zinntetrachlorid als (S4N4)2·SnCl4, mit Bortrifluorid als S4N4·BCl3, mit Arsenpentafluorid als S4N4·AsF5, mit Schwefeltrioxid als S4N4·SO3, mit Tantalpentachlorid als S4N4·TaCl5, mit Kupfer(I)-chlorid als S4N4·(CuCl)2 oder mit Eisen(III)-chlorid als S4N4·FeCl3.[1][16] Das Addukt mit Aluminiumchlorid S4N4·(AlCl3)4 stellt ein Addukt S2N2·(AlCl3)2 dar, da das Tetraschwefeltetranitrid durch das Aluminiumchlorid zum Dischwefeldinitrid aufgespalten wurde.[1]
Verwendung
Tetraschwefeltetranitrid ist einer der wichtigsten Ausgangsstoffe zur Herstellung von Schwefel-Stickstoff-Verbindungen.[14] Durch die Umsetzung mit Silber(II)-fluorid erfolgt eine Fluorierung an den Schwefelatomen, wobei der Achtring erhalten bleibt.[14]
Mit Quecksilber(II)-fluorid wird trimeres Thiazylfluorid (NSF)3 bzw. mit Chlor das Thiazylchlorid gebildet.[14][16]
Eine Reduktion erfolgt am Stickstoffatom. Im gebildeten Tetraschwefeltetraimid bleibt der Achtring erhalten. Die Verbindung ähnelt dem S8-Ring, wobei jedes zweite S-Atom durch eine NH-Gruppe ausgetauscht ist.[14][16] Die Reduktion mit Iodwasserstoff ist vollständig und führt zum Ammoniak und Schwefelwasserstoff.[1]
Eine kontrollierte thermische Zersetzung ergibt das Dischwefeldinitrid, welches sich weiter in das Polythiazyl umwandelt.[14]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p E. Wiberg, N. Wiberg, A.F. Holleman: Anorganische Chemie. 103. Auflage. Walter de Gruyter, Berlin/ Boston 2017, ISBN 978-3-11-026932-1, S. 676–680, (abgerufen über De Gruyter Online).
- ↑ a b c d Eintrag zu Schwefel-Stickstoff-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. März 2017.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ M. Gregory: in Z. Pharm. 21, 1835, S. 315 und 22, 1835, S. 301.
- ↑ J.-M. Fordos, A. Gélis: Memoire sur le sulfure d´azote. In: Compt. Rend. 31, 1850, S. 702ff.
- ↑ R Schenck: in Liebigs Ann. Chem. 290, 1896, S. 171.
- ↑ M. H. M. Arnold, J. A. C. Hugill, J. M. Hutson: The formation and constitution of sulphur nitride and so-called hexasulphamide. In: J. Chem. Soc. (London) 1936, S. 1645–1649, doi:10.1039/JR9360001645.
- ↑ M. H. M. Arnold: The structure of (SNH)4 and its derivatives. In: J. Chem. Soc. (London) 1938, S. 1596–1597, doi:10.1039/JR9380001596.
- ↑ M. Goehring: Über den Schwefelstickstoff N4S4. In: Chem. Ber. 80, 1947, S. 110–122, doi:10.1002/cber.19470800204.
- ↑ M. Goehring, J. Ebert: Ein chemischer Beweis für Mesomerie bei Tetraschwefeltetranitrid. In: Z. Naturforsch. B 10, 1955, S. 241–244, (pdf)
- ↑ D. Clark: The structure of sulphur nitride. In: J. Chem. Soc. 1952, S. 1615–1620, doi:10.1039/JR9520001615.
- ↑ B. D. Sharma, J. Donohue: The Crystal and Molecular Structure of Sulfur Nitride, S4N4. In: Acta Cryst. 16, 1963, S. 891–897, doi:10.1107/S0365110X63002401.
- ↑ a b c C. Janiak, H.-J. Meyer, D. Gudat, R. Alsfasser: Riedel - Moderne Anorganische Chemie. 4. Auflage. Walter de Gruyter, Berlin/ Boston 2012, ISBN 978-3-11-024900-2, S. 129–130, (abgerufen über De Gruyter Online).
- ↑ a b c d e f Ralf Steudel: Chemie der Nichtmetalle, Synthesen - Strukturen - Bindung - Verwendung. 4. Auflage. Walter de Gruyter, Berlin/ Boston 2014, ISBN 978-3-11-030439-8, S. 515–519, (abgerufen über De Gruyter Online).
- ↑
- ↑ a b c Lothar Kolditz: Anorganische Chemie. Deutscher Verlag der Wissenschaften, Berlin 1983, S. 480f.




![{\displaystyle \mathrm {2\ SCl_{4}+2\ [(Me_{3}Si)_{2}N]_{2}S\longrightarrow S_{4}N_{4}+8\ Me_{3}SiCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4999c4f622a4218626915496351102ead71ad771)











