Scandiumnitrat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
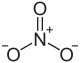
| |||||||
| Allgemeines | |||||||
| Name | Scandiumnitrat | ||||||
| Andere Namen |
Scandiumtrinitrat | ||||||
| Summenformel | Sc(NO3)3 | ||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 393,11 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Löslichkeit |
löslich in Wasser (169 g·l−1 bei 20 °C) und Ethanol[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Scandiumnitrat ist eine anorganische chemische Verbindung des Scandiums aus der Gruppe der Nitrate.
Gewinnung und Darstellung
Scandiumnitrat kann durch Reaktion von Scandium mit Distickstofftetroxid gewonnen werden.[3]
Das Anhydrat kann auch durch Reaktion von Scandiumchlorid mit Distickstoffpentaoxid gewonnen werden.[4] Das farblose Tetrahydrat kann man durch Reaktion von Scandiumhydroxid mit Salpetersäure darstellen.[5]
Eigenschaften
Scandiumnitrat ist ein weißer Feststoff, der löslich in Wasser und Ethanol ist.[1] Von der Verbindung sind mehrere Hydrate bekannt, so das Di-, Tri- und Tetrahydrat. Das Tetra- und das Trihydrat besitzen eine monokline Kristallstruktur. Erwärmt man das Tetrahydrat an Luft, dann wandelt es sich bei 50 °C in das Dihydrat um. Dieses setzt sich jedoch schon bei 60 °C zu einer Verbindung mit dem Aufbau Sc4O3(NO3)3·6,5H2O um. Bei 140–220 °C bildet sich daraus Sc4O5(NO3)3.[4]
Einzelnachweise
- ↑ a b c d
- ↑ a b Datenblatt Scandium(III) nitrate hydrate, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 15. Mai 2014 (PDF).
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1109.
- ↑ a b
- ↑

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0)

