Silberbromat
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
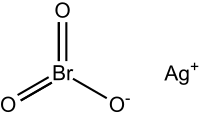
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Silberbromat | ||||||||||||
| Andere Namen |
Silber(I)-bromat | ||||||||||||
| Summenformel | AgBrO3 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 235,77 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
5,206 g·cm−3 (25 °C)[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−10,5 kJ/mol[5] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Silberbromat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Bromate.
Gewinnung und Darstellung
Silberbromat kann durch Reaktion von Silbernitrat mit einer Bromat-Lösung (z. B. von Kaliumbromat) gewonnen werden.[4]
Eigenschaften
Silberbromat ist ein weißer lichtempfindlicher Feststoff, der schlecht löslich in Wasser ist. Er zersetzt sich bei Erhitzung.[6] Er hat eine tetragonale Kristallstruktur mit der Raumgruppe I4/m (Raumgruppen-Nr. 87) und den Gitterparametern a = 860 pm und c = 809 pm sowie acht Formeleinheiten pro Elementarzelle.[7]
Verwendung
Silberbromat wird als Oxidationsmittel zur Umsetzung von Tetrahydropyranylethern zu Carbonyl-Verbindungen verwendet.[1]
Einzelnachweise
- ↑ a b c d e f Datenblatt Silver bromate, 97% bei Sigma-Aldrich, abgerufen am 25. Juli 2013 (PDF).
- ↑ Peter. Ruoff, Margit. Varga, Endre. Koros (1987) Silver bromate precipitation in bromate oscillators treated with excess silver ion. A comment. J. Phys. Chem., 91 (16), 4431–4432. doi:10.1021/j100300a047
- ↑ Michelle Davidson: Inorganic Chemistry. Lotus Press, 2006, ISBN 81-89093-39-8, S. 170 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b G. Charlot, R. G. Murray: Qualitative Inorganic Analysis. CUP Archive, 1954, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis, 2011, ISBN 1-4398-1462-7, S. 365 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 282 (eingeschränkte Vorschau in der Google-Buchsuche).


