Silberwolframat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
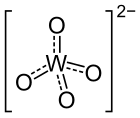
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Silberwolframat | ||||||||||||
| Andere Namen |
Silberwolframoxid | ||||||||||||
| Summenformel | Ag2WO4 | ||||||||||||
| Kurzbeschreibung |
hellgelber geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 463,57 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Silberwolframat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Wolframate.
Gewinnung und Darstellung
Silberwolframat kann durch Reaktion einer Silbernitratlösung mit Natriumwolframat gewonnen werden.[4]
Eigenschaften
Silberwolframat ist ein hellgelber geruchloser Feststoff, der praktisch unlöslich in Wasser ist.[1] Die Verbindung kommt in mehreren Modifikationen vor. Die α-Form besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pn2n (Raumgruppen-Nr. 34, Stellung 3) (a = 10,820, b = 12,018, c = 5,900 Å). Die metastabile β-Form hat eine hexagonale Kristallstruktur mit der Raumgruppe P63 (Raumgruppen-Nr. 173) oder Raumgruppe P63/m (Raumgruppen-Nr. 176) und die γ-Form hat eine kubische Kristallstruktur vom Spinelltyp mit Raumgruppe Fd3m (Raumgruppen-Nr. 227) (a = 9,352 Å).[5][6]
Verwendung
Silberwolframat wird in der elektronischen und chemischen Industrie (z. B. als Sensormaterial,[7] Zusatz zu Schaltkontakten[8] oder Photokatalysator[9]) eingesetzt. Es wird auch in der Biochemie für die Proteomik-Forschung verwendet.[1]
Einzelnachweise
- ↑ a b c d e Datenblatt Silver tungsten oxide, 99% bei AlfaAesar, abgerufen am 12. Juni 2016 (PDF) (JavaScript erforderlich).
- ↑ a b c Datenblatt Silver wolframat, 99.95% trace metals basis bei Sigma-Aldrich, abgerufen am 12. Juni 2016 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2016, ISBN 978-1-4398-8050-0, S. 102 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Sreedevi, K. P. Priyanka, K. K. Babitha, N. Aloysius Sabu, T. S. Anu, T. Varghese: Chemical synthesis, structural characterization and optical properties of nanophase α-Ag2WO4. In: Indian Journal of Physics. 89, 2015, S. 889, doi:10.1007/s12648-015-0664-1.
- ↑ A. J. van den Berg, C. A. H. Juffermans: The polymorphism of silver tungstate Ag2WO4. In: Journal of Applied Crystallography. 15, 1982, S. 114, doi:10.1107/S0021889882011510.
- ↑ Pablo S. Lemos, A. Altomare, A. F. Gouveia, I. C. Nogueira, L. Gracia, R. Llusar, J. Andrés, E. Longo, Laécio S. Cavalcante: Synthesis and characterization of metastable β-Ag2WO4: an experimental and theoretical approach. In: Dalton Trans.. 45, 2016, S. 1185, doi:10.1039/c5dt03754a.
- ↑ Luís F. da Silva, Ariadne C. Catto, Waldir Avansi, Laécio S. Cavalcante, Juan Andrés, Khalifa Aguir, Valmor R. Mastelaro, Elson Longo: A novel ozone gas sensor based on one-dimensional (1D) α-Ag2WO4 nanostructures. In: Nanoscale. 6, 2014, S. 4058, doi:10.1039/C3NR05837A.
- ↑ Werner Schatt, Klaus-Peter Wieters, Bernd Kieback (Hrsg.): Pulvermetallurgie. Technologien und Werkstoffe (= VDI-Buch). 2., bearb. und erw. Auflage. Springer Science & Business Media, 2007, ISBN 978-3-540-23652-8, S. 419 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Haihang Chen, Yiming Xu: Photoactivity and stability of Ag2WO4 for organic degradation in aqueous suspensions. In: Applied Surface Science. 319, 2014, S. 319, doi:10.1016/j.apsusc.2014.05.115.

