Simonis-Chromon-Synthese
Die Simonis-Chromon-Synthese ist eine Namensreaktion in der Organischen Chemie. Entdeckt wurde sie 1913 von den Chemikern Ernst Petschek und Hugo Simonis.[1][2] Sie dient der Synthese von Chromon aus Phenol und einem β-Ketoester.[3][4][5]
Übersichtsreaktion
Bei dieser P2O5-katalysierten Reaktion entsteht aus Phenol und einem β-Ketoester unter Cyclisierung Chromon:[3][4]
Die Reaktion kann auch mit substituierten Phenolen und anderen β-Ketoestern ablaufen.[3][4]
Mechanismus
Der komplexe Mechanismus der Simonis-Chromon-Synthese wird in der Literatur noch diskutiert.[4]
Es wird angenommen, dass zunächst das Phenol 1 von der Unterseite das Oxoniumion 2 angreift. Dabei kommt es zur Bildung des Übergangszustandes 3. In einer doppelten Elimierungsreaktion wird zuerst Wasser abgespalten, wodurch das Molekül 4 entsteht. Nach dem anschließenden Eliminieren von Ethanol kommt es zur Bildung von 2-Methylchromon 5.[4]
Anwendung
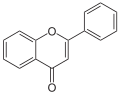
Chromon (1,4-Benzopyron) bildet das Grundskelett der Flavone (2-Phenylchromone) und Isoflavone (3-Phenylchromone). Isoflavone kommen als gelber Farbstoff in einigen Pflanzen und ihren Blüten vor. Die Simonis-Chromon-Synthese kommt bei der Herstellung von Flavonen zur Anwendung. Dabei reagiert Phenol mit Benzoylessigsäureethylester (Enol-Tautomer) unter Katalyse von P2O5 zu dem natürlichen Polymethin-Farbstoff Flavon.[3] Außerdem kann die Simonis-Chromon-Synthese eingesetzt werden, um das Naturprodukt Visnagin herzustellen, welches in einigen Früchten vorkommt.[4]
Siehe auch
Einzelnachweise
- ↑ Organic chemistry. In: Journal of the Chemical Society, Abstracts. Band 104, Nr. 0, 1913, S. i813–i921 (890), doi:10.1039/CA9130400813.
- ↑ Ernst Petschek, H. Simonis: Eine neue Chromon-Synthese. In: Berichte der deutschen chemischen Gesellschaft. Band 46, Nr. 2, 1913, S. 2014–2020, doi:10.1002/cber.191304602117.
- ↑ a b c d Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Verbindungsklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe, Syntheseplanung, Nachhaltigkeit Vol. 7. Georg Thieme Verlag, Stuttgart, 2012, ISBN 978-3-13-541507-9, S. 695–696.
- ↑ a b c d e f Jie Jack Lie, Elias James Corey (Hrsg.): Name Reactions in Heterocyclic Chemistry II. John Wiley & Sons, Ltd, 2011, ISBN 978-1-118-09282-8, Six-Membered Heterocycles, S. 479–486, doi:10.1002/9781118092828.ch8.
- ↑ Martha Windholz, Susan Budavari, Lorraine Y. Stroumtos, Margaret Noether Fertig: The Merck Index An Encyclopedia of Chemicals and Drugs Vol. 9, Merck & Co., INC., Rahway, NJ, 1976, ISBN 0-911910-26-3, S. ONR-82.