Squalensynthase
| Squalensynthase | ||
|---|---|---|
|
Vorhandene Strukturdaten: 1EZF | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 417 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer; multipass Membranprotein (ER) | |
| Kofaktor | Mg2+ | |
| Bezeichner | ||
| Gen-Name | FDFT1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.5.1.21, Transferase | |
| Reaktionsart | Übertragung eines Farnesylrests | |
| Substrat | 2 Farnesyldiphosphat + 2 NADPH/H+ | |
| Produkte | Squalen + 2 PPi + 2 NADP+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten[1] | |
Squalensynthase (SQS) (auch: Farnesyldiphosphat-Farnesyltransferase, FDFT) ist das Enzym, das in Eukaryoten die Kondensationsreaktion von zwei Molekülen Farnesyldiphosphat zu Squalen katalysiert. Dies ist ein Teilschritt in der Cholesterinbiosynthese, und die erste Reaktion, die in Tieren ausschließlich zum Cholesterin führt. Es handelt sich um ein Transmembranprotein, das am endoplasmatischen Reticulum lokalisiert ist. SQS ist ein vielversprechendes pharmakologisches Target für die Senkung des Cholesterinspiegels.[2][3]
Es gibt homologe Enzyme in Carotin-produzierenden Organismen, die als Teilschritt dieser Synthese Geranylgeranyldiphosphat (GGPP) zu Phytoen kondensieren.[1]
Katalysierte Reaktion
Die Reaktion findet in zwei Teilschritten statt:
Zuerst kondensieren zwei Farnesyldiphosphat-Moleküle zu Präsqualendiphosphat.
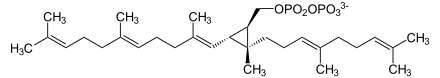 + 2 NADPH/H+ ⇔
+ 2 NADPH/H+ ⇔
⇔  + 2 NADP+ + PPi
+ 2 NADP+ + PPi
Anschließend wird Präsqualendiphosphat zu Squalen reduziert und umgelagert.
Weblinks
- Jassal / reactome: Two FPP molecules dimerize to form presqualene diphosphate
- Jassal / reactome: Reduction of presqualene diphosphate to form squalene
Einzelnachweise
- ↑ a b InterPro IPR006449 Farnesyl-diphosphate farnesyltransferase. European Institute of Bioinformatics (EBI), abgerufen am 15. August 2011 (englisch).
- ↑ UniProt P37268
- ↑ Do R, Kiss RS, Gaudet D, Engert JC: Squalene synthase: a critical enzyme in the cholesterol biosynthesis pathway. In: Clin. Genet.. 75, Nr. 1, Januar 2009, S. 19–29. doi:10.1111/j.1399-0004.2008.01099.x. PMID 19054015.