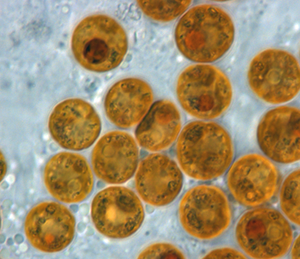
Symbiodinium
| Symbiodinium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Symbiodinium | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Symbiodinium | ||||||||||||
| Gert Hansen & Daugbjerg, 2009[1] |

Symbiodinium ist eine Gattung von Dinoflagellaten, die in traditioneller Auffassung die größte und am weitesten verbreitete Gruppe der bekannten endosymbiotisch lebenden Dinoflagellaten umfasst. Diese einzelligen Algen leben häufig im Endoderm von tropischen Nesseltieren wie Stein- und Oktokorallen, Seeanemonen und Quallen, wo die Produkte ihrer Photosynthese-Aktivität im Wirt gegen anorganische Moleküle ausgetauscht werden. Sie werden auch von verschiedenen Arten von Schwämmen, Plattwürmern, Mollusken (wie den Riesenmuscheln), Foraminiferen (wie den Soritacea) und einigen Wimpertierchen beherbergt.
Im Allgemeinen werden die Dinoflagellaten durch Phagozytose in die Wirtszelle aufgenommen, werden aber nicht verdaut, sondern überdauern als intrazelluläre Symbionten (Endocytobionten). Eine Ausnahme bilden die meisten Mollusken, bei denen sie interzellulär (also nicht in, sondern zwischen den Zellen) leben. Nesseltiere, die mit Symbiodinium vergesellschaftet sind, kommen meist in warmen oligotrophen (nährstoffarmen), marinen Lebensräumen vor, wo sie oft die benthischen Lebensgemeinschaften dominieren und prägen. Symbiodinium-Arten (in traditioneller Auffassung, d. h. unter Einschluss der neu abgetrennten Gattungen der Familie der Symbodiniaceae) gehören daher zu den am häufigsten vorkommenden eukaryotischen Mikroben in den Ökosystemen von Korallenriffen. Arten von Symbiodinium im engeren Sinne sind allerdings, soweit bisher bekannt, mit Ausnahme der Feuerkorallen keine Symbionten von riffbildenden Korallenarten.
Die endosymbiotischen Symbiodinium-Vertreter werden aufgrund ihrer gelblich-bräunlichen Farbe auch informell (nicht-taxonomisch) als Zooxanthellen klassifiziert; Tiere, die mit solchen Algen im Symbiose leben, nennt man auch „zooxanthellat“. Der Begriff wird aber lose verwendet und bezieht sich auf alle goldbraunen endosymbiotisch lebenden Protisten, darunter auch Kieselalgen und andere Dinoflagellaten.[Anm. 1]
Im Jahr 2018 wurde die Systematik der Familie Symbiodiniaceae überarbeitet und die einzelnen Kladen wurden neu in sieben Gattungen eingeteilt.[2] Nach dieser Überarbeitung ist der Name Symbiodinium nun ein Gattungsname nur für Arten, die zuvor provisorisch als Symbiodinium „Klade A“ bezeichnet wurden.[2] Für andere Kladen wurden neue taxonomisch eigenständige Gattungen geschaffen (siehe §Molekulare Systematik unten).
Intrazelluläre Symbionten

Viele Symbiodinium-Arten sind vor allem durch ihre Rolle als mutualistische Endosymbionten (Endosymbionten zum gegenseitigen Nutzen) bekannt. In Wirten kommen sie normalerweise in hohen Dichten vor, die von Hunderttausenden bis zu Millionen pro Quadratzentimeter der Korallenoberfläche reichen.[3]
Die erfolgreiche Kultivierung von freischwimmenden Zellen, die damals irrtümlich der Gattung Gymnodinium, Ordnung Gymnodiniales zugeordnet wurden, aus Korallen führte um 1950 zur Entdeckung, dass als „Zooxanthellen“ bezeichneten Organellen oder Einschlusskörperchen eigentlich Dinoflagellaten sind.[4][5]
Die in einer Wirtszelle lebenden Symbiodinium-Zellen liegen immer in der kokkoiden Form (Kokken-ähnlich, das heißt mehr oder weniger kugelförmig – „Kokken“ sind informell kugelförmige Bakterien, keine Eukaryoten wie Symbiodinium) vor und sind neben ihren eigenen von einer zusätzlichen, dritten Membran umgeben, die während der Phagozytose aus dem Plasmalemma (Zellmembran) der Wirtszelle gebildet wird (ähnlich wie die Epiplastidmembran der komplexen Plastiden, als Folge einer sekundäre oder noch höheren Endosymbiose). Wahrscheinlich wird ihr Proteingehalt dabei etwas modifiziert., Das könnte dazu dienen, die Phago-Lysosom-Fusion zu begrenzen oder zu verhindern. Die Vakuolenstruktur, die den Symbionten enthält, wird daher auch als Symbiosom bezeichnet. Jedes Symbiosom wird von einer einzigen Symbiontenzelle bewohnt. Es ist unklar, wie sich diese Membran ausdehnt, um eine sich teilende Symbiontenzelle aufzunehmen. Unter normalen Bedingungen tauschen Symbionten- und Wirtszellen organische und anorganische Moleküle aus, die das Wachstum und die Vermehrung beider Partner ermöglichen.[6][7][8][9][10][11]
Korallenbleiche
Symbiodinium ist einer der am besten untersuchten Symbionten. Seine wechselseitigen Beziehungen mit riffbildenden Korallen bilden die Grundlage für ein äußerst vielfältiges und produktives Ökosystem. Korallenriffe haben einen wirtschaftlichen Nutzen, der jedes Jahr auf Hunderte von Milliarden US-Dollar geschätzt wird.[12] Die Erforschung der Biologie von Symbiodinium wird daher vor allem durch den Wunsch angetrieben, den weltweiten Rückgang der Korallenriffe zu verstehen. Ein Hauptmechanismus für die weit verbreitete Riffzerstörung ist die stressinduzierte Korallenbleiche, die durch ungewöhnlich hohe Meerwassertemperaturen verursacht wird. Bleichen entstehen durch die Dissoziation der Koralle und des Symbionten (d. h. der Auflösung der Symbiose durch Ausstoßen des Symbionten) und/oder durch den der Verlust von Chlorophylls innerhalb der Alge. Äußerlich erkennbar ist dies am schnellen Verlust der Pigmentierung des Tieres, das danach weiß gefärbt ist. Viele Symbiodinium-Nesseltier-Assoziationen werden von einer anhaltenden Erhöhung der Meeresoberflächentemperaturen beeinträchtigt.[13] Weitere Faktoren sind:
- hohe Bestrahlungsstärken (einschließlich Ultraviolettstrahlung, UV, en. UVR, siehe Ozonloch)[14][15]
- umgekehrt extrem niedrige Temperaturen[16]
- abnorm niedrigen Salzgehalt[17]
- Umweltverschmutzung (Schadstoffe wie Schwermetalle, Öle, Pestizide, Mikroplastik)[18][19]
Der Zustand der Bleiche ist verbunden mit einer verminderten Kalzifizierung des Wirts,[20] einer erhöhten Krankheitsanfälligkeit[21] und, wenn er länger andauert, mit teilweisem oder vollständigem Absterben verbunden.[22]
Das Ausmaß der Korallensterbens durch ein einzelnes Bleichereignis kann globale Ausmaße annehmen, wie es 2015 der Fall war. Es wird vorhergesagt, dass diese Episoden häufiger und schwerwiegender werden, da die Temperaturen weltweit weiter ansteigen.[23]
Die Physiologie der jeweiligen symbiontischen Symbiodinium-Art beeinflusst oft die Bleichanfälligkeit einer Koralle.[24][25] Die physiologische Basis der thermischen Toleranz ist daher heute ein wichtiger Forschungsansatz.[26][27][28][29] Die Identifizierung der Ökologie und Verbreitung von thermisch toleranten Symbiontenarten kann Wege aufzeigen, wie die Riffe möglicherweise überleben können.[30][31][32]
2018 wurde festgestellt, dass die Art Symbiodinium thermophilum den Großteil der symbiontischen Algenpopulation in den Korallen des Persischen Golfs ausmacht. Sie kommt auch im Golf von Oman und im Roten Meer vor, allerdings in einer viel geringeren Konzentration. Korallen, die diese Art beherbergten, waren in der Lage, das 35 °C warme Wasser des Persischen Golfs zu tolerieren, viel heißer als die sonst üblichen 31 °C der Korallenriffe weltweit.[33]
Taxonomie und Systematik
Das Name Symbiodinium wurde, für eine neu beschriebene Art, Symbiodinium microadriaticum durch den in New York forschenden Meeresbiologen Hugo David Freudenthal eingeführt.[34] Freudenthal bearbeitete dabei Zooxanthellen, die John J.A. McLaughlin und Paul A. Zahl schon 1957 aus in der Karibik lebenden Quallen der Art Cassiopea xamachana isoliert hatten. Freudenthals Diagnose wurde in den darauffolgenden Jahren ergänzt; bis Mitte der 1980er Jahre herrschte aber die Auffassung vor, alle entsprechenden Zooxanthellen gehörten dieser einen Art an, da es nicht gelungen war, verlässliche morphologische Unterschiede zu finden. Erst 1997 beschrieben Robert K. Trench und Rudolf J. Blank drei zusätzliche neue Arten, danach kamen in rascher Folge weitere hinzu.
2017 machte Todd C. LaJeunesse dann darauf aufmerksam, dass Freudenthal es bei seiner Erstbeschreibung versäumt hatte, ein Typusexemplar zu designieren und in einer wissenschaftlichen Sammlung zu hinterlegen. Dies war nach dem Internationalen Code der Nomenklatur für Algen, Pilze und Pflanzen zwingend vorgeschrieben. Unglücklicherweise war inzwischen der Laborstamm, auf dessen Basis Freudenthal seine Art beschrieben hatte, verloren gegangen. Dies Versäumnis machte nun Freudenthals Beschreibung der Art Symbiodinium microadriaticum, und damit auch der Gattung Symbiodinium selbst, nomenklatorisch invalide.[35] LaJeunesse lieferte in derselben Arbeit eine formale Neubeschreibung, um den Namen Symbiodinium nachträglich noch zu validieren. Michael D. Guiry und Robert A. Andersen wiesen dann aber 2018 darauf hin[36], dass zwei andere Forscher, Gert Hansen und Niels Daugbjerg, im Jahr 2009 bei der Beschreibung einer neuen Art, Symbiodinium natans, in ihrer Arbeit auch eine Gattungsdiagnose geliefert hatten. Sie hatten damit den Namen, ohne es zu bemerken, validiert. Im taxonomischen Sinne ist daher heute Symbiodinium natans die Typusart der Gattung, nicht, wie früher angenommen, Symbiodinium microadriaticum (die erst durch die Neubeschreibung durch LaJeunesse 2017 nachträglich validiert worden ist, so dass heute formal er, nicht Freudenthal, als Artautor gilt). Schlimmer noch: da die Gattung erst 2009 validiert wurde, beruhen alle vor 2009 beschriebenen Arten dieser Gattung auf einem invaliden Gattungsnamen und mussten formal validiert werden. Durch die dadurch geschaffene Unsicherheit ist der formale Status etlicher Artnamen bis heute nicht abschließend geklärt.
Molekulare Systematik
Neuordnung
abgebildet in 3D mittels Konfokalmikroskopie der Chlorophyll-Autofluoreszenz.[2]
Die Anerkennung der Artenvielfalt in dieser Gattung blieb viele Jahrzehnte lang problematisch, da es schwierig war, die dafür nötigen morphologischen und biochemischen Merkmale zu identifizieren.[37]
Das Aufkommen des DNA-Sequenzvergleiche leitete eine Revolution in der Ordnung und Benennung aller Organismen ein. Die verbesserte und beschleunigte Genomanalyse erlaubt es heute, nicht nur einzelne genetische Marker (z. B. die Abschnitte LSU, ITS2 oder cp23S des Plastiden-Genoms) zu betrachten, sondern diese und andere Marker in Kombination, oder sogar das Genom als Ganzes, zu analysieren. Diese Methodik trug dazu bei, die lange Zeit vorherrschende Überzeugung, dass Symbiodinium eine einzige Art sei, infrage zu stellen. Hinweise darauf waren durch morphologischen, physiologischen und biochemischen Vergleich von kultivierten Isolaten schon lange Zeit bekannt gewesen. Nun wurden zusätzlich genetische Marker verwendet, um die evolutionären Beziehungen zwischen Mitgliedern dieser Gruppe abzuleiten. Bereits die frühesten ribosomalen Gensequenzdaten deuteten darauf hin, dass die Gattung Symbiodinium in ihrer herkömmlichen Form Abstammungslinien vereinte, deren genetische Divergenz ähnlich groß wie bei anderen Dinoflagellaten war, die verschiedenen Gattungen, Familien oder sogar Ordnungen zugeordnet worden waren.[38] Die große phylogenetische Disparität zwischen den Kladen A, B, C etc. (alle traditionell zu Symbiodinium gestellt) wurde durch Analysen der Sequenzen des mitochondrialen Genoms (Mitogenom oder Chondriom genannt) bestätigt – standardmäßig verwendet wird die Sequenz, die für die Cytochrom-c-Oxidase-Untereinheit I (CO1) kodiert.[39] Die meisten dieser Kladen umfassen zahlreiche genetisch unterschiedliche Linien, die zudem unterschiedliche ökologische Ansprüche und biogeografische Verbreitung aufweisen (s. u.).
Arten
Mit der Neuaufstellung der Gattung Symbiodinium sensu stricto (= Symbiodinium sensu lato Klade A) im Jahr 2018 wurden für die restlichen Kladen B bis G eigene Gattungen geschaffen, deren Anfangsbuchstaben mit dem jeweiligen Kladen-Buschstaben übereinstimmt:[2] Breviolum,[40][41] Cladocopium,[42][43] Durusdinium,[44][45] Effrenium,[44][46] Fugacium[47] und Gerakladium;[44][48] seitdem wurden einige der Kladen weiter gesplittet, wodurch weitere Gattungen wie Freudenthalidium,[44][49] Halluxium[44][50] und Miliolidium[44] entstanden bzw. (modifiziert) wiederhergestellt wurden, wie Philozoon.[51]
Die folgende Liste der so „verschlankten“ Gattung Symbiodinium sensu stricto (d. h. der Klade A) umfasst nur solche Arten, die keiner der neuen Gattungen zugeordnet werden. Die Liste beruht auf der taxonomischen Datenbank Algaebase[52] Aufgrund der oben geschilderten taxonomischen Probleme ist dabei der Status etlicher Artnamen noch ungeklärt. Diese sind in der Liste mit einem „U“ gekennzeichnet.
- Gattung Symbiodinium Gert Hansen & Daugbjerg, 2009
- Symbiodinium bermudense Trench U
- Symbiodinium californium A.T.Banaszak, R.Iglesias-Prieto & R.K.Trench U
- Symbiodinium cariborum Trench U
- Symbiodinium corculorum Trench U
- Symbiodinium fittii Pinzon, Devlin-Durante, M.X.Weber, Baums & LaJeunesse U
- Symbiodinium goreaui Trench & R.J.Blank ex LaJeunesse U
- Symbiodinium kawagutii Trench & Blank ex LaJeunesse U
- Symbiodinium linucheae (Trench & Thinh) LaJeunesse
- Symbiodinium meandrinae Trench U
- Symbiodinium microadriaticum LaJeunesse. Symbiont der Quallenart Cassiopea xamachana und möglicherweise anderer Cassiopea-Arten.
- Symbiodinium muscatinei LaJeunesse & Trench U
- Symbiodinium natans Gert Hansen & Daugbjerg (Typusart der Gattung)
- Symbiodinium necroappetens LaJeunesse, S.Y.Lee, Knowlton & H.J.Jeong. Freilebend, gelegentlich opportunistischer Symbiont von Cassiopea und von Nesseltieren wie Gorgonien
- Symbiodinium pilosum Trench & R.J.Blank ex LaJeunesse U. Freilebende Art, keine dauerhaften Symbiosen bekannt.
- Symbiodinium pulchrorum Trench U
- Symbiodinium thermophilum B.C.C.Hume, C.D’Angelo, E.G.Smith, J.R.Stevens, J.Burt & J.Wiedenmann
- Symbiodinium tridacnidarum S.Y.Lee, H.J.Jeong, N.S.Kang & LaJeunesse Symbiont von Cassiopea und von Riesenmuscheln der Gattung Tridacna, im Pazifik.
- Symbiodinium tridacnorum Hollande & Carré U
Ausblick
Die Analyse zusätzlicher phylogenetischer Marker für Symbiodinium-Vertretern, die in Symbiose mir Nesseltieren, ausschließlich freilebend in unterschiedlichen, oft benthischen Lebensräumen vorkommen, ist noch lange nicht zu Ende und die Gesamtartenzahl der Symbiodinium-Arten kann möglicherweise nie genau bestimmt werden.[53][54][55][56][57][58][59]
Klondiversität und Populationsgenetik
Durch die Verwendung von Mikrosatelliten-Markern können Multilocus-Genotypen,[Anm. 2] die eine einzelne klonale Linie[Anm. 3] von Symbiodinium identifizieren, aus Proben von Wirtsgewebe identifiziert werden. Es scheint, dass die meisten individuellen Kolonien einen einzigen Multilocus-Genotyp (d. h. einen Klon) beherbergen. D. h. alle Symbiodinium-Endosymbionten sind in der ganzen Kolonie genetisch identisch. Ausgedehnte Probenahmen innerhalb der Kolonien haben bestätigten, dass viele Kolonien des jeweiligen Nesseltier-Wirts eine homogene (klonale) Symbiodinium-Population beherbergen.[60][61] Zusätzliche Genotypen innerhalb einer Kolonie kommen zwar gelegentlich vor, doch selten wurden mehr als zwei oder drei gefunden. Wenn mehrere Klone in der gleichen Kolonie vorhanden sind, zeigen sie oft schmale Überlappungszonen innerhalb der Kolonie.[61] Umgekehrt können nebeneinander liegende Kolonien in einem Riff identische Klone beherbergen, aber in der gesamten Wirtspopulation ist die Klonvielfalt einer bestimmten Symbiodinium-Art potenziell groß und umfasst auch Genotypen, die erkennbar das Produkt sexueller Rekombination sind. Ein Klon neigt dazu, in einer Kolonie über viele Monate und Jahre dominant zu bleiben, kann aber gelegentlich verdrängt oder ersetzt werden. Die wenigen Studien, die die Ausbreitung von Klonen untersucht haben, zeigen, dass die meisten Genotypen eine begrenzte geografische Verbreitung haben, dass aber die Ausbreitung und der Genfluss wahrscheinlich von der Lebensgeschichte des Wirts und der Art des Symbiontenerwerbs, horizontal (durch Aufnahme von außen) oder vertikal (durch Vererbung auf die Nachkommen), beeinflusst werden.[60][61]
Artenvielfalt, Ökologie und Biogeographie
Geografische Verteilungen und artbezogene Muster
Da die Aufspaltung der alten Sammelgattung Symbiodinium s. l. erst 2018 erfolgte, sind in der älteren Forschungsliteratur fast nur Angaben zu dieser enthalten, oft aber schon nach den damals unterschiedenen Kladen aufgeschlüsselt. Während Mitglieder einer bestimmten Klade weltweit verbreitet sein können, ist die Artenvielfalt innerhalb jeder Klade (Gattung) potenziell groß, wobei jede Art oft geografische Verbreitung und ökologische Vorlieben hat, die mit ihrer Ausbreitungsfähigkeit, der Wirtsbiogeografie und den äußeren Umweltbedingungen zusammenhängen. Nur eine kleine Anzahl von Arten kommt in gemäßigten Habitaten vor, wo nur wenige als Wirt geeignete symbiontische Tiere vorkommen.
Artenvielfalt nach ökologischen Gruppen aufgeschlüsselt
A. Wirtsnesseltiere können Millionen von Symbiontenzellen (lebensfähige und tote) pro Tag in die Umgebung ausstoßen (a). Im Gegenzug leiten diese Tiere große Mengen Wasser durch ihr Gastrovaskularsystem zur Atmung und Abfallbeseitigung, ein Prozess, der zahlreiche kleine Partikel, einschließlich Nahrung und verschiedene andere Symbiodinium-Arten, einbringt (angezeigt durch Unterschiede in der Zellfarbe) (b).
B. Die ökologische Nische unterscheidet sich bei den Symbiodinium-Arten. Es gibt mehrere ökologisch unterscheidbare Gruppen, darunter wirtsspezifische und wirtsgeneralistische Arten (1), Arten mit „
(Todd C. LaJeunesse, Allison M. Lewis)
Die durch die genetischen Analysen aufgedeckte große Vielfalt von Symbiodinium ist nicht zufällig verteilt und scheint mehrere Gruppen (Gilden) mit unterschiedlichen ökologischen Eigenschaften zu umfassen. Von den vielen Symbiodinium-Arten, sind die meisten wirtsspezifisch, mutualistisch und dominieren jeweils einen spezifischen Wirt.[63] Andere können kompatible Symbionten darstellen, deren Populationen mit geringer Abundanz (Häufigkeit im Lebensraum) quasi im Hintergrund verbleiben, weil sie unter den vorherrschenden Umweltbedingungen (z. B. hoher gegenüber geringer Lichtintensität) unterlegen sind.[64] Einige umfassen opportunistische Arten, die sich in Zeiten von physiologischem Stress des Wirts vermehren, dann den normalen Symbionten verdrängen und im Gewebe des Wirts für Monate bis Jahre reichlich vorhanden sind, bevor sie wieder durch den ursprünglichen Symbionten ersetzt werden.[31][65][66] Es gibt auch solche, die aufgrund schnellerer Infektionsrate Populationen in den Jungtieren des Wirts etablieren, bis sie später von den konkurrenzkräftigeren Symbionten ersetzt werden, die normalerweise mit den Kolonien des Wirts assoziiert sind.[67] Schließlich scheint es eine weitere Gruppe von Symbiodinium-Arten zu geben, die nicht in der Lage sind, eine Endosymbiose zu etablieren, aber in der Umgebung des Tieres existieren oder eng mit anderen Substraten assoziiert sind, etwa Oberflächen von Makroalgen (Tang) oder Sedimentoberflächen[59][68] Die Existenz von Symbiodinium aus den letzteren Funktionsgruppen ist gut bekannt, da sie sich leicht kultivieren lassen, jedoch sind Arten mit diesen Eigenschaften aufgrund ihrer geringen Häufigkeit direkt in der Umwelt schwer zu untersuchen.
Freilebende und „nicht-symbiotische“ Populationen
Es gibt nur wenige Beispiele für dokumentierte Populationen von freilebenden Symbiodinium-Arten.[59] Da die meisten Wirtslarven ihre Symbionten zunächst aus der Umgebung erwerben müssen, müssen lebensfähige Symbiodinium-Zellen auch außerhalb des Wirts vorkommen. Die motile (bewegliche) Phase ist wahrscheinlich in der äußeren Umgebung wichtig und erleichtert die schnelle Infektion der Wirtslarven.
Die Verwendung von aposymbiotischen[Anm. 4] Wirtspolypen, die als Köder (en.
) eingesetzt werden, und die Anwendung molekularer Techniken haben es ermöglicht, auch solche Symbiodinium-Vorkommen in der Umwelt aufzuspüren.[66][69]
Mit diesen Methoden lässt sich die Verteilung verschiedener Arten auf verschiedenen benthischen Oberflächen[68] und die Dichte von in der Wassersäule schwebenden Zellen[70] aufklären.
Die genetischen Identitäten von Zellen, die aus der Umwelt gewonnen werden, unterscheiden sich oft von denen in den Wirten. Dies liegt offenbar daran, dass es auch völlig freilebende Arten gibt, die zu unterscheiden sind von sich gerade ausbreitenden eigentlich symbiotischen Arten.[63]
Kultivierung
Bestimmte Symbiodinium-Stämme und/oder -Arten lassen sich leichter kultivieren und können in künstlichen oder ergänzten Meerwassermedien[71] jahrzehntelang überleben. Der Vergleich von kultivierten Isolaten unter identischen Bedingungen zeigt deutliche Unterschiede in Morphologie, Größe, Biochemie, Genexpression, Schwimmverhalten, Wachstumsraten usw.[72][73][74] Dieser vergleichende Ansatz erwies sich als bahnbrechend, indem er einen (langsamen) Paradigmenwechsel in der Erkenntnis einleitete, dass diese Gattung Symbiodinium in ihrem herkömmlichen Umfang so unterschiedliche Organismen zusammenfasste, dass eine Aufspaltung unerlässlich war. Tatsächlich sind immer noch von den wirtsspezifischen Arten – im Gegensatz zu den wirtsgeneralistischen – die meisten erst noch zu kultivieren, was natürlich schwieriger ist. Die Kultivierung ist ein selektiver Prozess, und viele Symbiodinium-Isolate, die auf künstlichen Medien wachsen, sind nicht typisch für die Arten, die normalerweise mit einem bestimmten Wirt assoziiert sind. Damit die resultierende Kultur in ihrer genetischen Identität mit der Wildtyp des dominanten und ökologisch relevanten Symbionten abgeglichen werden kann, sollten Proben für die genetische Analyse direkt von der Ausgangskolonie gewonnen werden.[63][75][76]
Lebenszyklus
Der Lebenszyklus von Symbiodinium wurde erstmals anhand von Zellen beschrieben, die in Kulturmedien wachsen. Bei Isolaten, die sich in der exponentiellen Wachstumsphase befinden, treten Teilungsraten alle ein bis drei Tage auf, wobei Symbiodinium-Zellen zwischen einer kokkoiden (d. h. kugelförmigen) Morphologie und einem kleineren, begeißelten, beweglichen sogenannten Mastigotenstadium wechseln (s. u. §Morphologie). Mit Hilfe von licht- und elektronenmikroskopischen Färbungsmethoden der Zelle bzw. des Zellkerns konnte dargestellt werden, wie jedes morphologische Stadium in das andere übergeht, so dass eine Rekonstruktion des Lebenszyklus möglich war.[77]
Während der ungeschlechtlichen Vermehrung (manchmal auch als mitotisches oder vegetatives Wachstum bezeichnet) durchlaufen die Zellen in Dunkelheit einen Tagesgang der Karyokinese (alias Mitose: Chromosomen- bzw. Kernteilung der Eukaryoten). Die Mutterzelle teilt sich dann kurz nach der Lichtexposition (Zytokinese: anschließende eigentliche Zellteilung) und setzt damit zwei bewegliche Zellen frei. Der Beginn und die Dauer der Motilität (Bewegungsfähigkeit) variiert zwischen den Arten.[77] Am Ende der Lichtphase stellen die Mastigoten das Schwimmen ein, resorbieren ihre Geißeln und machen eine schnelle Metamorphose in die kokkoide Form durch. Wenn Kulturen diese stationäre Wachstumsphase erreichen, werden immer weniger bewegliche Zellen beobachtet, was auf langsamere Teilungsraten hinweist.
Große Tetraden (Aggregate aus vier Zellen) werden gelegentlich beobachtet, insbesondere wenn Zellen der stationären Wachstumsphase auf frische Medien übertragen werden. Es ist jedoch nicht bekannt,
- ob dieses Stadium das Ergebnis von zwei aufeinanderfolgenden mitotischen Teilungen ist,
- oder vielleicht ein Prozess, der sexuell kompetente, bewegliche Zellen (d. h. Gameten) erzeugt,
- oder ob es das Endergebnis der Meiose nach der Gametenfusion (Vereinigung männlicher und weiblicher Gameten) ist.
Zwar fehlen (noch) zytologischen Beweise für eine sexuelle Rekombination, und eine Meiose wurde nie beobachtet, aber populationsgenetische Studien unterstützen die Ansicht, dass Symbiodinium periodisch Ereignisse sexueller Rekombination durchläuft. Wie, wann und wo die sexuelle Phase in ihrem Lebenszyklus auftritt, ist bislang unbekannt (Stand 2004).[53][78][79]
Morphologie

(A) Nahaufnahme geteilter Zellen einer Tetrade (Vierzell-Aggregat) aus einer Kultur von Symbiodinium corculorum, die genetisch ähnlich zu Symbiodinium pilosum ist (beide sind Subtyp A2). Diese Subklade ist ungewöhnlich für Symbiodinium-Arten, da sie Mucozysten[80][Anm. 5] und Chloroplasten mit parallelen und peripheren Thylakoidanordnungen besitzt. Flagellen (Geißeln) sind im Querschnitt im Raum zwischen den Tochterzellen zu sehen.
(B) Bei vielen kultivierten Isolaten wird eine dicke Zellwand (aus Zellulose) beobachtet.
(C) TEM-Aufnahme eines Querschnitts durch einen Chloroplastenlappen an der Peripherie der Zelle mit parallelen und peripheren Thylakoiden, die in Dreiergruppen (Tripletts) angeordnet sind.
Die morphologische Beschreibung der Gattung Symbiodinium basiert ursprünglich auf der ehemaligen Typusart (Holotyp) Symbiodinium microadriaticum.[37][83] Diese besitzen wie oben erwähnt zwei Hauptstadien in ihrem Lebenszyklus: das mastigote (begeißelte bewegliche) und das kokkoide (kugelförmige unbewegliche) Stadium.
Begeißelte (mastigote) Zellen
Die bewegliche Geißelform („Mastigot“, vgl. Geißeltierchen) ist athekat (auch „athecat“ oder „nackt“)[Anm. 6] und ähnlich wie bei den Gymnodiniales (einer anderen Dinophyceen-Ordnung).[84] Die relativen Dimensionen des Epikons[85] und des Hypokons[86] unterscheiden sich von Art zu Art.[37][Anm. 7] Die Alveolen sind in der beweglichen Phase am deutlichsten sichtbar, haben aber keine aus Zellulosefasern bestehenden festen Platten wie bei den („gepanzerten“) Dinoflagellaten mit ihren Thecen.
Zwischen den Ursprungspunkten der beiden Geißeln befindet sich eine dehnbare Struktur mit unbekannter Funktion, die Pedunkel (en.
, „Stiel“) genannt wird. Bei anderen Dinoflagellaten wurde eine analoge Struktur mit der heterotrophen Ernährung („ausziehbarer Stiel, der zum Fangen von Beute verwendet wird“) und der sexuellen Rekombination in Verbindung gebracht. Bei Symbiodinium wird jedoch vermutet, dass der Stiel an der Substratbefestigung beteiligt sein könnte, was erklärt, warum sich bestimmte Zellen an Ort und Stelle zu drehen scheinen.[83]
Im Vergleich zu anderen gymnodinioiden Gattungen gibt es am Sulcus[Anm. 8]
an dem die Enden der Cigulumfurche (en.
)[Anm. 9] zusammenlaufen, wenig oder keine Verschiebung (en.
Die inneren Organellen der Mastigote sind im Wesentlichen die gleichen wie in der kokkoiden Form (siehe unten). Der Übergang von der Mastigote zum kokkoiden Stadium bei Symbiodinium erfolgt schnell, aber Details über die Veränderungen sind nicht bekannt. Unter dem Plasmalemma (Zellmembran) befinden sich bei Symbiodinium pilosum Mucozysten[80][Anm. 5] mit nicht bekannter Funktion, sie könnten aber an der heterotrophen Ernährung beteiligt sein.
Kokkoide Zellen
Die kokkoide (sphärisch-kugelförmige) Form von Symbiodinium hat einen durchschnittlichen Durchmesser von je nach Art 6 bis 13 µm.[87] Das kokkoide Stadium wird oft fälschlicherweise als „Dinozyste“ bezeichnet, weshalb diese Form in der Literatur oft als vegetative „Zyste“ bezeichnet wird.[83] Der Begriff „Zyste“ bezieht sich bei Einzellern in der Regel auf ein Ruhestadium ohne Stoffwechsel im Lebenszyklus anderer Dinoflagellaten, das durch verschiedene Faktoren wie Nährstoffverfügbarkeit, Temperatur und Tageslänge initiiert wird. Solche Zysten ermöglichen eine größere Resistenz gegenüber ungünstigen Umweltbedingungen.[88] Kokkoide Symbiodinium-Zellen sind dagegen metabolisch aktiv, da sie Photosynthese betreiben, Mitosen durchlaufen und aktiv Proteine und Nukleinsäuren synthetisieren. Während die meisten Dinoflagellaten Mitose als begeißelte, motile Zelle (Mastigote) durchlaufen, findet die Mitose bei Symbiodinium ausschließlich in der kokkoiden Zelle statt.[77]
Die Zelle ist im kokkoiden Stadium von einer zellulosehaltigen, meist glatten Zellwand umgeben, die auch großmolekulare Proteine und Glykoproteine enthält.[37][89] Die Zellwand wird in Kultur dicker als innerhalb einer Wirtszelle.[6] Unter der Zellwand befindet sich die Zellmembran (Plasmalemma), über deren Zusammensetzung und Funktion im Hinblick auf die Regulation des Transmembrantransports von Metaboliten (Stoffwechselprodukten) noch wenig bekannt ist. Während der Karyokinese (Mitose, Kernteilung) und Zytokinese (Zellteilung) bleibt die Zellwand intakt, bis die beweglichen Mastigoten die Mutterzelle verlassen. In der Kultur sammeln sich die abgestoßenen Wände am Boden des Kulturgefäßes an. Es ist nicht bekannt, was aus den Wänden geteilter Zellen von Endozytobionten wird.[90] Eine Art, Symbiodinium pilosum, zeigt büschelweise haarähnliche Vorsprünge aus der Zellwand herausragen, dies ist das einzige bekannte Oberflächenmerkmal, das zur Bestimmung einer Art in dieser Gattung verwendet wird.
Chloroplast
Die meisten beschriebenen Arten besitzen einen einzelnen, peripheren, netzartigen Chloroplasten, der von drei Membranen begrenzt wird. Der vom Chloroplasten eingenommene Anteil am Volumen der Zelle variiert zwischen den Arten.[37] Es gibt Lamellen aus drei eng aneinander liegenden (gestapelten) Thylakoiden, diese sind über zwei Stiele mit dem Pyrenoid verbunden,[37] das von einer Stärkehülle umgeben ist. Bei drei der beschriebenen Arten liegen die Thylakoide in parallelen Anordnungen vor, bei Symbiodinium pilosum gibt es aber auch periphere Lamellen. Im Gegensatz zu anderen symbiotischen Dinoflagellaten gibt es keine Thylakoidmembranen, die in das Pyrenoid eindringen.[91][92] Zu den Lipidkomponenten der Thylakoide gehören die Galactolipide mit Monogalactosyl-Diglyceriden (MGDG)[93] und Digalactosyl-Diglyceriden (DGDG),[94] das Sulfolipid Sulphochinovosyl-Diglycerid (SQDG),[95] Phosphatidylglycerin[96] und Phosphatidylcholin. Damit assoziiert sind verschiedene Fettsäuren.[97] Zu den Lichtsammel- und Reaktionszentrumskomponenten in der Thylakoidmembran gehören ein wasserlöslicher Peridinin-Chlorophyll-a-Protein-Komplex (PCP oder PerCP)[98] und ein membrangebundener Chlorophyll-a-Chlorophyll-c2-Peridinin-Protein-Komplex (acpPC),[99] sowie typische photosynthetische Elektronentransportsysteme wie das Reaktionszentrum des Photosystems II und der Chl.-a-P700-Reaktionszentrumskomplex des Photosystems I.[100][101]
Ebenfalls mit den Thylakoiden assoziiert sind die Xanthophylle Dinoxanthin, Diadinoxanthin, Diatoxanthin und unter den Carotinen das β-Carotin. Das Pyrenoid enthält das kernkodierte[Anm. 11] Enzym Typ II Ribulose-bis-phosphat-carboxylase-oxygenase (RuBisCO), das für die Katalyse von anorganischem Kohlendioxid in organische Verbindungen verantwortlich ist.[102]
Alle kultivierten Isolate (d. h. Stämme) sind zu einer Anpassung ihres Fähigkeit zur Lichtsammlung als Teil ihres Phänotyps fähig, z. B. durch Veränderung des zellulären Chlorophyll a- und Peridinin-Verhältnisses sowie der Größe und Anzahl der photosynthetischen Einheiten.[103]
Die Fähigkeit zur Lichtsammlung ist ein Spiegelbild der genetischen Unterschiede zwischen den Arten, die als Ergebnis ihrer eigenen Evolution jeweils unterschiedlich an eine bestimmte Lichtverhältnisse angepasst sind. So wurde etwa Symbiodinium pilosum als stark lichtadaptierte Art beschrieben, während andere Arten wie Symbiodinium kawagutii schwach lichtadaptiert oder wie Symbiodinium microadriaticum an einen größeren Bereich von variierenden Lichtverhältnissen angepasst sind.[104][105]
Zellkern
Im Allgemeinen ist der Zellkern zentral gelegen und der Nukleolus (das Kernkörperchen) ist oft mit der inneren Kernmembran verbunden. Die Chromosomen sind, wie bei anderen Dinoflagellaten, in TEM-Aufnahmen als „permanent supercoiled DNA“ zu sehen.[106] Die bekannten Symbiodinium-Arten besitzen unterschiedliche Chromosomenzahlen (von 26 bis 97),[37] die über alle Phasen des Kernzyklus konstant bleiben. Während der M-Phase (Kern- plus Zellteilung) wird jedoch das Volumen jedes Chromosoms halbiert, ebenso wie das Volumen jedes der beiden entstehenden Kerne. Somit bleibt das Verhältnis von Chromosomenvolumen zu Kernvolumen konstant. Diese Beobachtungen belegen übereinstimmend mit molekulargenetischen Daten, dass die Algen haploid sind.[107] Während der S-Phase (Interphase) des Kernzyklus wickeln sich die Chromosomen ab, um die DNA-Synthese zu erleichtern. Die Volumina sowohl der Chromosomen als auch des Kerns kehren zu denen zurück, die im G2-Stadium zu sehen sind.[106]
Andere Organellen des Zytoplasmas
Im Zytoplasma von Symbiodinium finden sich mehrere zusätzliche Organellen.
Die auffälligste davon ist die Struktur, die als „Akkumulationskörper“ (en.
) bezeichnet wird. Dabei handelt es sich um ein membrangebundenes Vesikel (Vakuole), dessen Inhalt nicht auflösbar ist, aber unter dem Lichtmikroskop rot oder gelb erscheint. Er kann zur Akkumulation von Zelltrümmern dienen oder als autophagische Vakuole fungieren, in der nicht funktionsfähige Organellen verdaut und ihre Bestandteile recycelt werden. Während der Mitose scheint nur eine Tochterzelle diese Struktur zu erhalten.
Andere Vakuolen können membranöse Einschlüsse enthalten können, während wieder andere kristallines Material enthalten, das unterschiedlich als Oxalat- oder Harnsäurekristalle interpretiert wird.[108]
Literatur
- Jingchun Li, Megan Volsteadt, Lisa Kirkendale, Colleen M. Cavanaugh: Characterizing Photosymbiosis Between Fraginae Bivalves and „Symbiodinium“ Using Phylogenetics and Stable Isotopes. In: Frontiers in Ecology and Evolution. 25. April 2018, doi:10.3389/fevo.2018.00045 (Herzmuscheln)
Weblinks
- EoL: Zooxanthellae: Symbiodinium, auf: Encyclopedia of Life
- Close-up of a Coral Polyp, Symbiodinium, auf Smithsonian Ocean Portal
- Coral and algae relationship, auf: Elemental Solutions Caribbean (escaribbean) vom 26. Juni 2016. Quelle: Preparing for a new relationship: Coral and algae interactions explored, auf: EreuekAlert! vom 23. Juni 2016
Einzelnachweise
- ↑ NCBI: Symbiodinium Freudenthal, 1962 (genus), graphisch: Symbiodinium, auf: Lifemap, NCBI Version.
- ↑ a b c d Todd C. LaJeunesse, John Everett Parkinson, Paul W. Gabrielson, Hae Jin Jeong, James Davis Reimer, Christian R. Voolstra, Scott R. Santos: Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. In: Current Biology. 28, Nr. 16, August 2018, S. 2570–2580. doi:10.1016/j.cub.2018.07.008. (open access), insbesondere Abb. 3
- ↑ J. Stimson, K. Sakai, H. Sembali: Interspecific comparison of the symbiotic relationship in corals with high and low rates of bleaching-induced mortality. In: Coral Reefs. 21, Nr. 4, Dezember 2002, S. 409–421. doi:10.1007/s00338-002-0264-3.
- ↑ Siro Kawaguti: On the physiology of reef corals VI. Study on the pigments. In: Palau Tropical Biological Station Studies. 2, 1944, S. 617–674.
- ↑ John J. A. McLaughlin, Paul A. Zahl: Axenic Zooxanthellae from Various Invertebrate Hosts. In: Annals of the New York Academy of Sciences. 77, Nr. 2, 1959, S. 55–72. doi:10.1111/j.1749-6632.1959.tb36892.x.
- ↑ a b Nansi J. Colley, Robert K. Trench: Selectivity in Phagocytosis and Persistence of Symbiotic Algae by the Scyphistoma Stage of the Jellyfish Cassiopeia xamachana. In: Proceedings of the Royal Society B. 219, Nr. 1214, 1983, S. 61–82. doi:10.1098/rspb.1983.0059..
- ↑ Timothy S. Wakefield, Stephen C. Kempf: Development of host- and symbiont-specific monoclonal antibodies and confirmation of the origin of the symbiosome membrane in a cnidarian-dinoflagellate symbiosis. In: The Biological Bulletin. 200, Nr. 2, 2001, S. 127–143. doi:10.2307/1543306..
- ↑ Shao-En Peng, Yu-Bao Wang, Li-Hsueh Wang, Wan-Nan Uang Chen, Chi-Yu Lu, Lee-Shing Fang, Chii-Shiarng Chen: Proteomic analysis of symbiosome membranes in Cnidaria-dinoflagellate endosymbiosis. In: Proteomics. 10, Nr. 5, 2010, S. 1002–1016. doi:10.1002/pmic.200900595.
- ↑ Bor L. Tang: Thoughts on a very acidic symbiosome, in: Frontiers in Microbiology 6: 816 doi:10.3389/fmicb.2015.00816 (open access)
- ↑ Malcolm Hill, April Hill April: The magnesium inhibition and arrested phagosome hypotheses: new perspectives on the evolution and ecology of Symbiodinium symbioses, in: Biological Reviews. Cambridge Philosophical Society Band 87, Nr. 4, November 2012, S. 804–821, doi:10.1111/j.1469-185X.2012.00223.x
- ↑ Alex P. Camaya: Stages of the symbiotic zooxanthellae–host cell division and the dynamic role of coral nucleus in the partitioning process: a novel observation elucidated by electron microscopy, in: Coral Reefs, Band 39, Nr. 4, S. 929-938. doi:10.1007/s00338-020-01912-y
- ↑ Fredrik Moberg, Carl Folke: Ecological goods and services of coral reef ecosystems. In: Ecological Economics. 29, Nr. 2, 1999, S. 215–233. doi:10.1016/S0921-8009(99)00009-9.
- ↑ P. L. Jokiel, S. L. Coles: Response of Hawaiian and other Indo-Pacific reef corals to elevated temperature. In: Coral Reefs. 8, Nr. 4, 1990, S. 155–162. doi:10.1007/BF00265006.
- ↑ Michael P. Lesser: Elevated temperatures and ultraviolet radiation cause oxidative stress and inhibit photosynthesis in symbiotic dinoflagellates. In: Limnology and Oceanography. 41, Nr. 2, 1996, S. 271–283. doi:10.4319/lo.1996.41.2.0271. (open access)
- ↑ William Fitt, Barbara Brown, Mark Warner, Richard Dunne: Coral bleaching: Interpretation of thermal tolerance limits and thermal thresholds in tropical corals. In: Coral Reefs. 20, Nr. 1, 2001, S. 51–65. doi:10.1007/s003380100146.
- ↑ Todd C. Lajeunesse, Robin Smith, Mariana Walther, Jorge Pinzon, Daniel T. Pettay, Michael McGinley, Matthew Aschaffenburg, Pedro Medina-Rosas, Amilcar L. Cupul-Magana, Andrés López Pérez, Hector Reyes-Bonilla, Mark E. Warner: Host-symbiont recombination versus natural selection in the response of coral-dinoflagellate symbioses to environmental disturbance. In: Proceedings of the Royal Society B: Biological Sciences. 277, Nr. 1696, 2010, S. 2925–2934. doi:10.1098/rspb.2010.0385..
- ↑ Thomas F Goreau: Mass Expulsion of Zooxanthellae from Jamaican Reef Communities after Hurricane Flora. In: Science. 145, Nr. 3630, 1964, S. 383–386. doi:10.1126/science.145.3630.383.
- ↑ Barbara E. Brown: The significance of pollution in eliciting the 'bleaching' response in symbiotic cnidarians. In: International Journal of Environment and Pollution. 13, Nr. 1–6, 2000, S. 392–415. doi:10.1504/IJEP.2000.002328.
- ↑ Marcelo de Oliveira Soares, Eliana Matos, Caroline Lucas, Lucia Rizzo, Louise Allcock, Sergio Rossi: Microplastics in corals: An emergent threat, in: Marine Pollution Bulletin, Band 161, Part A, 111810, 2020 doi:10.1016/j.marpolbul.2020.111810
- ↑ Colombo-Pallotta et al. 2010
- ↑ Marilyn E. Brandt, John W. McManus: Disease incidence is related to bleaching extent in reef-building corals. In: Ecology. 90, Nr. 10, 2009, S. 2859–2867. doi:10.1890/08-0445.1..
- ↑ Andrew C. Baker, Peter W. Glynn, Bernhard Riegl: Climate change and coral reef bleaching: An ecological assessment of long-term impacts, recovery trends and future outlook. In: Estuarine. 80, Nr. 4, 2008, S. 435–471. doi:10.1016/j.ecss.2008.09.003.
- ↑ Ove Hoegh-Guldberg, P. J. Mumby, A. J. Hooten, R. S. Steneck, P. Greenfield, E. Gomez, C. D. Harvell, P. F. Sale, A. J. Edwards, K. Caldeira, Nancy Knowlton, C. M. Eakin, R. Iglesias-Prieto, N. Muthiga, R. H. Bradbury, A. Dubi, M. E. Hatziolos: Coral Reefs Under Rapid Climate Change and Ocean Acidification. In: Science. 318, Nr. 5857, 2007, S. 1737–1742. doi:10.1126/science.1152509.
- ↑ R. Berkelmans, M. J. H. Van Oppen: The role of zooxanthellae in the thermal tolerance of corals: A 'nugget of hope' for coral reefs in an era of climate change. In: Proceedings of the Royal Society B: Biological Sciences. 273, Nr. 1599, 2006, S. 2305–2312. doi:10.1098/rspb.2006.3567.
- ↑ E. M. Sampayo, T. Ridgway, P. Bongaerts, Ove Hoegh-Guldberg: Bleaching susceptibility and mortality of corals are determined by fine-scale differences in symbiont type. In: Proceedings of the National Academy of Sciences USA. 105, Nr. 30, 2008, S. 10444–10449. doi:10.1073/pnas.0708049105..
- ↑ Jennifer D. Robison, Mark E. Warner: Differential Impacts of Photoacclimation and Thermal Stress on the Photobiology of Four Different Phylotypes of Symbiodinium (Pyrrhophyta). In: Journal of Phycology. 42, Nr. 3, 2006, S. 568–579. doi:10.1111/j.1529-8817.2006.00232.x.
- ↑ Mark E. Warner, Todd C. Lajeunesse, Jennifer D. Robison, Rebecca M. Thur: The ecological distribution and comparative photobiology of symbiotic dinoflagellates from reef corals in Belize: Potential implications for coral bleaching. In: Limnology and Oceanography. 51, Nr. 4, 2006, S. 1887–1897. doi:10.4319/lo.2006.51.4.1887.
- ↑ Maria Ragni, Ruth L. Airs, Sebastian J. Hennige, David J. Suggett, Mark E. Warner, Richard J. Geider: PSII photoinhibition and photorepair in Symbiodinium (Pyrrhophyta) differs between thermally tolerant and sensitive phylotypes. In: Marine Ecology Progress Series. 406, 2010, S. 57–70. doi:10.3354/meps08571. (open access)
- ↑ Shunichi Takahashi, Spencer Whitney, Shigeru Itoh, Tadashi Maruyama, Murray Badger: Heat stress causes inhibition of the de novo synthesis of antenna proteins and photobleaching in cultured Symbiodinium. In: Proceedings of the National Academy of Sciences USA. 105, Nr. 11, 2008, S. 4203–4208. doi:10.1073/pnas.0708554105..
- ↑ Yi-T. Lien, Y. Nakano, S. Plathong, H. Fukami, Jih-T. Wang, C. A. Chen: Occurrence of the putatively heat-tolerant Symbiodinium phylotype D in high-latitudinal outlying coral communities. In: Coral Reefs. 26, Nr. 1, 2007, S. 35–44. doi:10.1007/s00338-006-0185-7.
- ↑ a b Todd C. Lajeunesse, Robin T. Smith, Jennifer Finney, Hazel Oxenford: Outbreak and persistence of opportunistic symbiotic dinoflagellates during the 2005 Caribbean mass coral 'bleaching' event. In: Proceedings of the Royal Society B: Biological Sciences. 276, Nr. 1676, 2009, S. 4139–4148. doi:10.1098/rspb.2009.1405.
- ↑ Todd C. Lajeunesse, Daniel T. Pettay, Eugenia M. Sampayo, Niphon Phongsuwan, Barbara Brown, David O. Obura, Ove Hoegh-Guldberg, William K. Fitt: Long-standing environmental conditions, geographic isolation and host-symbiont specificity influence the relative ecological dominance and genetic diversification of coral endosymbionts in the genus Symbiodinium. In: Journal of Biogeography. 37, Nr. 5, 2010, S. 785–800. doi:10.1111/j.1365-2699.2010.02273.x.
- ↑ Benjamin C. C. Hume, Cecilia D'Angelo, John A. Burt, Jörg Wiedenmann: Fine-Scale Biogeographical Boundary Delineation and Sub-population Resolution in the Symbiodinium thermophilum Coral Symbiont Group From the Persian/Arabian Gulf and Gulf of Oman, in: Frontiers in Marine Science 5: 138. doi:10.3389/fmars.2018.00138 (open access)
- ↑ Hugo D. Freudenthal (1962): Symbiodinium gen. nov. and Symbiodinium microadriaticum sp. nov., a Zooxanthella: Taxonomy, Life Cycle, and Morphology. Journal of Protozoology 9 (1): 45–52.
- ↑ T. C. LaJeunesse (2017): Validation and description of Symbiodinium microadriaticum, the type species of Symbiodinium (Dinophyta) (Note). Journal of Phycology 53 (5): 1109–1114. doi:10.1111/jpy.12570
- ↑ Michael D. Guiry & Robert A. Andersen (2018): Validation of the generic name Symbiodinium (Dinophyceae, Suessiaceae) revisited and the reinstatement of Zooxanthella K.Brandt. Notulae algarum 58: 1–5.
- ↑ a b c d e f g Robert K. Trench, Rudolf J. Blank: Symbiodinium Microadriaticum Freudenthal, S. Goreauii Sp. Nov., S. Kawagutii Sp. Nov. And S. Pilosum Sp. Nov.: Gymnodinioid Dinoflagellate Symbionts of Marine Invertebrates. In: Journal of Phycology. 23, Nr. 3, 1987, S. 469–481. doi:10.1111/j.1529-8817.1987.tb02534.x.
- ↑ Rob Rowan, Dennis A. Powers: Ribosomal RNA sequences and the diversity of symbiotic dinoflagellates (zooxanthellae). In: Proceedings of the National Academy of Sciences of the United States of America. Band 89, Nr. 8, 1992, S. 3639–3643, doi:10.1073/pnas.89.8.3639.
- ↑ Rowena F. Stern, Ales Horak, Rose L. Andrew, Mary-Alice Coffroth, Robert A. Andersen, Frithjof C. Küpper, Ian Jameson, Mona Hoppenrath, Benoît Véron, Fumai Kasai, Jerry Brand, Erick R. James, Patrick J. Keeling: Environmental Barcoding Reveals Massive Dinoflagellate Diversity in Marine Environments. In: PLoS ONE. 5, Nr. 11, 2010, S. e13991. doi:10.1371/journal.pone.0013991.
- ↑ AlgaeBase: Breviolum J.E.Parkinson & LaJeunesse, 2018
- ↑ Kaz Kawamura, Satoko Sekida, Koki Nishitsuji, Eiichi Shoguchi, Kanako Hisata, Shigeki Fujiwara, Noriyuki Satoh: In vitro Symbiosis of Reef-Building Coral Cells With Photosynthetic Dinoflagellates, in: Front. Mar. Sci., 14. Juli 2021, doi:10.3389/fmars.2021.706308, dazu:
- Nadja Podbregar: So fangen Korallen ihre Symbionten — Forscher beobachten erstmals die Aufnahme von Algen durch Korallenzellen, auf scinexx.de vom 22. Juli 2021
- ↑ Daniel J. Thornhill, Allison M. Lewis, Drew C. Wham, Todd C. LaJeunesse: Host-Specialist Lineages Dominate The Adaptive Radiation of Reef Coral Endosymbionts. in: Evolution, Band 68, Nr. 2, S. 352–367. doi:10.1111/evo.12270
- ↑ AlgaeBase: Cladocopium LaJeunesse & H.J.Jeong, 2018
- ↑ a b c d e f Xavier Pochon, Todd C. LaJeunesse: Miliolidium n. gen, a New Symbiodiniacean Genus Whose Members Associate with Soritid Foraminifera or Are Free-Living, in: Journal of Eukaryotic Microbiology, Band 68, Nr. 4, e12856, 2021 doi:10.1111/jeu.12856.
- ↑ AlgaeBase: Durusdinium LaJeunesse, 2018
- ↑ AlgaeBase: Effrenium LaJeunesse & H.J.Jeong
- ↑ AlgaeBase: Fugacium LaJeunesse, 2018
- ↑ AlgaeBase: Gerakladium LaJeunesse, 2018
- ↑ AlgaeBase: Freudenthalidium M.Nitschke, C.Brandão & C.Fidalgo, 2020
- ↑ AlgaeBase: Halluxium Calado, Craveiro &Frommlet, 2020
- ↑ Todd C. LaJeunesse, Joerg Wiedenmann, Pilar Casado-Amezúa, Isabella D’Ambra, Kira E. Turnham, Matthew R. Nitschke, Clinton A. Oakley, Stefano Goffredo, Carlos A. Spano, Victor M. Cubillos, Simon K. Davy, David J. Suggett: Revival of Philozoon Geddes for host-specialized dinoflagellates, ‘zooxanthellae’ in animals from coastal temperate zones of northern and southern hemispheres, in: European Journal of Phycology, Epub 28. Juni 2021, doi:10.1080/09670262.2021.1914863.
- ↑ Symbiodinium Gert Hansen & Daugbjerg, 2009. M.D. Guiry in Guiry, M.D. & Guiry, G.M. 2021. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. www.algaebase.org, abgerufen am 13 Juli 2021.
- ↑ a b S. R. Santos, T. L. Shearer, A. R. Hannes, M. A. Coffroth: Fine-scale diversity and specificity in the most prevalent lineage of symbiotic dinoflagellates (Symbiodinium, Dinophyceae) of the Caribbean. In: Molecular Ecology. Band 13, Nr. 2, 2004, S. 459–469, doi:10.1046/j.1365-294x.2003.02058.x.
- ↑ J. Christine Finney, Daniel Tye Pettay, Eugenia M. Sampayo, Mark E. Warner, Hazel A. Oxenford, Todd C. Lajeunesse: The Relative Significance of Host–Habitat, Depth, and Geography on the Ecology, Endemism, and Speciation of Coral Endosymbionts in the Genus Symbiodinium. In: Microbial Ecology. 60, Nr. 1, 2010, S. 250–263. doi:10.1007/s00248-010-9681-y..
- ↑ E. M. Sampayo, S. Dove, Todd C. Lajeunesse: Cohesive molecular genetic data delineate species diversity in the dinoflagellate genus Symbiodinium. In: Molecular Ecology. 18, Nr. 3, 2009, S. 500–519. doi:10.1111/j.1365-294X.2008.04037.x.
- ↑ Todd C. Lajeunesse, Daniel J. Thornhill: Improved Resolution of Reef-Coral Endosymbiont (Symbiodinium) Species Diversity, Ecology, and Evolution through psbA Non-Coding Region Genotyping. In: PLoS ONE. 6, Nr. 12, 2011, S. e29013. doi:10.1371/journal.pone.0029013.
- ↑ Daniel J. Thornhill, Todd C. Lajeunesse, Scott R. Santos: Measuring rDNA diversity in eukaryotic microbial systems: How intragenomic variation, pseudogenes, and PCR artifacts confound biodiversity estimates. In: Molecular Ecology. 16, Nr. 24, 2007, S. 5326–5340. doi:10.1111/j.1365-294X.2007.03576.x.
- ↑ X. Pochon, L. Garcia-Cuetos, A. C. Baker, E. Castella, J. Pawlowski: One-year survey of a single Micronesian reef reveals extraordinarily rich diversity of Symbiodinium types in soritid foraminifera. In: Coral Reefs. 26, Nr. 4, 2007, S. 867–882. doi:10.1007/s00338-007-0279-x.
- ↑ a b c James Davis Reimer, Md Mahfuzur Rahman Shah, Frederic Sinniger, Kensuke Yanagi, Shoichiro Suda: Preliminary analyses of cultured Symbiodinium isolated from sand in the oceanic Ogasawara Islands, Japan. In: Marine Biodiversity. 40, Nr. 4, 2010, S. 237–247. doi:10.1007/s12526-010-0044-1.
- ↑ a b Jason P. Andras, Nathan L. Kirk, C. Drew Harvell: Range-wide population genetic structure of Symbiodinium associated with the Caribbean Sea fan coral, Gorgonia ventalina. In: Molecular Ecology. 20, Nr. 12, 2011, S. 2525–2542. doi:10.1111/j.1365-294X.2011.05115.x.
- ↑ a b c Daniel T. Pettay, Drew C. Wham, Jorge H. Pinzón, Todd C. Lajeunesse: Genotypic diversity and spatial-temporal distribution of Symbiodinium clones in an abundant reef coral. In: Molecular Ecology. 20, Nr. 24, 2011, S. 5197–5212. doi:10.1111/j.1365-294X.2011.05357.x.
- ↑ Moo Joon Lee, Hae Jin Jeong, Se Hyeon Jang, Sung Yeon Lee, Nam Seon Kang, Kyung Ha Lee, Hyung Seop Kim, Drew C. Wham, Todd C. LaJeunesse: Most Low-Abundance “Background” Symbiodinium spp. Are Transitory and Have Minimal Functional Significance for Symbiotic Corals, in: Microbial Ecology, Band 71, S. 771–783, 2016, doi:10.1007/s00248-015-0724-2, insbes. Fig. 5
- ↑ a b c Todd C. LaJeunesse: Diversity and community structure of symbiotic dinoflagellates from Caribbean coral reefs. In: Marine Biology. 141, Nr. 2, 2002, S. 387–400. doi:10.1007/s00227-002-0829-2.
- ↑ Rob Rowan, Nancy Knowlton, Andrew Baker, Javier Jara: Landscape ecology of algal symbionts creates variation in episodes of coral bleaching. In: Nature. 388, Nr. 6639, 1997, S. 265–269. doi:10.1038/40843.
- ↑ Wesley W. Toller, Rob Rowan, Nancy Knowlton: Repopulation of Zooxanthellae in the Caribbean corals Montastraea annularis and M. faveolata following experimental and disease-associated bleaching. In: Biological Bulletin. Band 201, Nr. 3, 2001, S. 360–373, doi:10.2307/154361.
- ↑ a b Daniel J. Thornhill, Todd C. LaJeunesse, Dustin W. Kemp, William K. Fitt, Gregory W. Schmidt: Multi-year, seasonal genotypic surveys of coral-algal symbioses reveal prevalent stability or post-bleaching reversion. In: Marine Biology. 148, Nr. 4, 2005, S. 711–722. doi:10.1007/s00227-005-0114-2.
- ↑ Mary Alice Coffroth, Scott R. Santos, Tamar L. Goulet: Early ontogenetic expression of specificity in a cnidarian-algal symbiosis. In: Marine Ecology Progress Series. 222, 2001, S. 85–96. doi:10.3354/meps222085. (open access)
- ↑ a b Isabel Porto, Camila Granados, Juan C. Restrepo, Juan A. Sánchez: Macroalgal-Associated Dinoflagellates Belonging to the Genus Symbiodinium in Caribbean Reefs. In: PLoS ONE. 3, Nr. 5, 2008, S. e2160. doi:10.1371/journal.pone.0002160.
- ↑ Mary Alice Coffroth, Cynthia F. Lewis, Scott R. Santos, Jessica L. Weaver: Environmental populations of symbiotic dinoflagellates in the genus Symbiodinium can initiate symbioses with reef cnidarians. In: Current Biology. 16, Nr. 23, 2006, S. R985–7. doi:10.1016/j.cub.2006.10.049.
- ↑ Mackenzie M. Manning, Ruth D. Gates: Diversity in populations of free-living Symbiodinium from a Caribbean and Pacific reef. In: Limnology and Oceanography. 53, Nr. 5, 2008, S. 1853–1861. doi:10.4319/lo.2008.53.5.1853.
- ↑ Culturing, §How did we culture?, iGEM, Georgia State University, Atlanta
- ↑ David A. Schoenberg, Robert K. Trench: Genetic Variation in Symbiodinium (=Gymnodinium) microadriaticum Freudenthal, and Specificity in its Symbiosis with Marine Invertebrates. I. Isoenzyme and Soluble Protein Patterns of Axenic Cultures of Symbiodinium microadriaticum. In: Proceedings of the Royal Society. Series B. 207, Nr. 1169, 1980, S. 405–427. doi:10.1098/rspb.1980.0031..
- ↑ David A. Schoenberg, R. K. Trench: Genetic Variation in Symbiodinium (=Gymnodinium) microadriaticum Freudenthal, and Specificity in its Symbiosis with Marine Invertebrates. II. Morphological Variation in Symbiodinium microadriaticum. In: Proceedings of the Royal Society B: Biological Sciences. 207, Nr. 1169, 1980, S. 429–444. doi:10.1098/rspb.1980.0032..
- ↑ David A. Schoenberg, Robert K. Trench: Genetic Variation in Symbiodinium (=Gymnodinium) microadriaticum Freudenthal, and Specificity in its Symbiosis with Marine Invertebrates. III. Specificity and Infectivity of Symbiodinium microadriaticum. In: Proceedings of the Royal Society of London. Series B. 207, Nr. 1169, 1980, S. 445–460. doi:10.1098/rspb.1980.0033..
- ↑ Scott R. Santos, Derek J. Taylor, Mary Alice Coffroth: Genetic Comparisons of Freshly Isolated Versus Cultured Symbiotic Dinoflagellates: Implications for Extrapolating to the Intact Symbiosis. In: Journal of Phycology. 37, Nr. 5, 2001, S. 900–912. doi:10.1046/j.1529-8817.2001.00194.x.
- ↑ Tamar L. Goulet, Mary-Alice Coffroth: Genetic composition of zooxanthellae between and within colonies of the octocoral Plexaura kuna, based on small subunit rDNA and multilocus DNA fingerprinting. In: Marine Biology. 142, Nr. 2, Februar 2003, S. 233–239. doi:10.1007/s00227-002-0936-0.
- ↑ a b c William K. Fitt, Robert K. Trench: The Relation of Diel Patterns of Cell Division to Diel Patterns of Motility in the Symbiotic Dinoflagellate Symbiodinium Microadria Ticum Freudenthal in Culture. In: New Phytologist. 94, Nr. 3, 1983, S. 421–432. doi:10.1111/j.1469-8137.1983.tb03456.x. (open access).
- ↑ B. K. Baillie, C. A. Belda-Baillie, V. Silvestre, M. Sison, A. V. Gomez, E. D. Gomez, V. Monje: Genetic variation in Symbiodinium isolates from giant clams based on random-amplified-polymorphic DNA (RAPD) patterns. In: Marine Biology. 136, Nr. 5, 2000, S. 829–836. doi:10.1007/s002270000290.
- ↑ Todd C. LaJeunesse: Investigating the Biodiversity, Ecology, and Phylogeny of Endosymbiotic Dinoflagellates in the Genus Symbiodinium Using the Its Region: In Search of A 'species' Level Marker. In: Journal of Phycology. 37, Nr. 5, 2001, S. 866–880. doi:10.1046/j.1529-8817.2001.01031.x.
- ↑ a b John D. Dodge, Claude Greuet; Frank John Rupert Taylor (Hrsg.): Dinoflagellate ultrastructure and complex organelles. In: The Biology of Dinoflagellates (= Botanical Monographs), Band 21. Blackwell Scientific Publications, Oxford 1987, ISBN 978-0-632-00915-2, S. 92–142.
- ↑ Stephan Nehring: Dinoflagellaten-Dauercysten in deutschen Küstengewässern: Vorkommen, Verbreitung und Bedeutung als Rekrutierungspotential, Dissertation: Berichte aus dem Institut für Meereskunde an der Christian-Albrechts-Universität Kiel, Abt. Marine Planktologie, Nr. 259, 1994, ISSN 0341-8561
- ↑ E. A. Titlyanov, T. V. Titlyanova, V. A. Leletkin, J. Tsukahara, R. van Woesik, K. Yamazato: Degradation of zooxanthellae and regulation of their density in hermatypic corals, in: Marine Ecology Progress Series, Band 139, Nr. 1/3, 1996, S. 167–178, doi:10.3354/meps139167
- ↑ a b c Hugo D. Freudenthal: Symbiodinium gen. Nov. And Symbiodinium microadriaticum sp. nov., a Zooxanthella: Taxonomy, Life Cycle, and Morphology. In: The Journal of Protozoology. 9, Nr. 1, 1962, S. 45–52. doi:10.1111/j.1550-7408.1962.tb02579.x.
- ↑ Frank John Rupert Taylor: Dinoflagellate morphology. In: The Biology of Dinoflagellates (= Botanical Monographs), Band 21. Blackwell Scientific Publications, Oxford 1987, ISBN 978-0-632-00915-2, S. 24–91.
- ↑ Marvin Wellkamp: LC-MS/MS basierte Analyse von Amphidinolen und weiteren marinen Phycotoxinen, Masterarbeit zur Biotechnologie an der Hochschule Bremerhaven, Alfred-Wegener-Institut (AWI), Helmholtz-Zentrum für Polar- und Meeresforschung, 1. Februar 2020, Alternativ-Link
- ↑ Shuang Xia, Qi Zhang, Huan Zhu, Yingyin Cheng, Guoxiang Liu, Zhengyu Hu: Systematics of a kleptoplastidal dinoflagellate, Gymnodinium eucyaneum Hu (Dinophyceae), and its cryptomonad endosymbiont, in: PLoS One, Band 8, Nr. 1, e53820, 2013, doi:10.1371/journal.pone.0053820
- ↑ Rudolf J. Blank,& Volker A. R. Huss: DNA divergency and speciation in Symbiodinium (Dinophyceae). In: Plant Systematics and Evolution. Band 163, S. 153–163, September 1989, doi:10.1007/BF00936511.
- ↑ Edward Lee Lee: Phycology, Chapter Dinophyta: Resting Spores or Cysts os Hypnospores and Fossil Dinophyceae, 4th. Auflage, Cambridge University Press, New York 2008, ISBN 978-1-139-46987-6, S. 356–357.
- ↑ Douglas A. Markell, Robert K. Trench, Roberto Iglesias-Prieto: Macromolecules associated with the cell-walls of symbiotic dinoflagellates. In: Symbiosis. 12, Nr. 1, 1992, S. 19–31.
- ↑ Timothy S. Wakefield, Mark A. Farmer, Stephen C. Kempf: Revised description of the fine structure of in situ 'zooxanthellae' genus Symbiodinium. In: Biological Bulletin. 199, Nr. 1, August 2000, S. 76–84. doi:10.2307/1542709..
- ↑ Robert K. Trench, Heather Winsor: Symbiosis with dinoflagellates in two pelagic flatworms, Amphiscolops sp. and Haplodiscus sp.. In: Symbiosis. 3, Nr. 1, 1987, S. 1–21.
- ↑ Anastazia T. Banaszak, Roberto Iglestas-Prieto, Robert K. Trench: Scrippsiella velellae sp. nov. (Peridiniales) and Gloeokinium viscum sp. nov. (Phytodiniales), Dinoflagellate Symbionts of Two Hydrozoans (Cnidaria). In: Journal of Phycology. 29, Nr. 4, 1993, S. 517–528. doi:10.1111/j.1529-8817.1993.tb00153.x.
- ↑ Monogalactosyl Diglyceride, auf biomol
- ↑ Digalactosyl diglyceride, auf: Merck Sigma-Aldrich
- ↑ Friederike Koenig: Konzentration einiger Lipide in den Chloroplasten von Zea mays und Antirrhinum majus. Zeitschrift für Naturforschung 26b, S. 1180–1187.
- ↑ Phosphatidylglycerol and Related Lipids, auf: The LipidWeb
- ↑ E. Díaz-Almeyda, Patricia E. Thomé, Mohammed El-Hafidi, Roberto Iglesias-Prieto: Differential stability of photosynthetic membranes and fatty acid composition at elevated temperature in Symbiodinium. In: Coral Reefs. 30, Nr. 1, 2011, S. 217–225. doi:10.1007/s00338-010-0691-5.
- ↑ Donatella Carbonera, Marilena Di Valentin, Riccardo Spezia, Alberto Mezzetti: The Unique Photophysical Properties of the Peridinin-Chlorophyll-a-Protein, in: Current Protein & Peptide Science, Band 15, Nr. 4, 2014, doi:10.2174/1389203715666140327111139
- ↑ Dariusz M. Niedzwiedzki, Jing Jiang, Cynthia S. Lo, Robert E. Blankenship: Spectroscopic properties of the Chlorophyll a–Chlorophyll c2–Peridinin-Protein-Complex (acpPC) from the coral symbiotic dinoflagellate Symbiodinium, in: Photosynthesis Research, Band 120, S. 125–139, 2014 doi:10.1007/s11120-013-9794-5
- ↑ Roberto Iglesias-Prieto, Govind S. Nadathur (N. S. Govind), Robert K. Trench: Apoprotein Composition and Spectroscopic Characterization of the Water-Soluble Peridinin–Chlorophyll a–Proteins from Three Symbiotic Dinoflagellates. In: Proceedings: Biological Sciences. 246, Nr. 1317, 1991, S. 275–283. doi:10.1098/rspb.1991.0155..
- ↑ Roberto Iglesias-Prieto, Govind S. Nadathur (N. S. Govind), Robert K. Trench: Isolation and Characterization of Three Membrane-Bound Chlorophyll-Protein Complexes from Four Dinoflagellate Species. In: Philosophical Transactions of the Royal Society B: Biological Sciences. 340, Nr. 1294, 1993, S. 381–392. doi:10.1098/rstb.1993.0080..
- ↑ Rob Rowan, Spencer M. Whitney, Amanda Fowler, David Yellowlees: Rubisco in marine symbiotic dinoflagellates: Form II enzymes in eukaryotic oxygenic phototrophs encoded by a nuclear multigene family. In: The Plant Cell Online. 8, Nr. 3, 1996, S. 539–553. doi:10.1105/tpc.8.3.539..
- ↑ S. J. Hennige, D. J. Suggett, M. E. Warner, K. E. McDougall, D. J. Smith: Photobiology of Symbiodinium revisited: Bio-physical and bio-optical signatures. In: Coral Reefs. 28, Nr. 1, 2009, S. 179–195. doi:10.1007/s00338-008-0444-x.
- ↑ Roberto Iglesias-Prieto, Robert K. Trench: Acclimation and adaptation to irradiance in symbiotic dinoflagellates. I. Responses of the photosynthetic unit to changes in photon flux density. In: Marine Ecology Progress Series. 113, Nr. 1, 1994, S. 163–175. doi:10.3354/meps113163. (open access)
- ↑ Roberto Iglesias-Prieto, Robert K. Trench: Acclimation and adaptation to irradiance in symbiotic dinoflagellates. II. Response of chlorophyll-protein complexes to different photon-flux densities. In: Marine Biology. 130, Nr. 1, 1997, S. 23–33. doi:10.1007/s002270050221.
- ↑ a b Rudolf J. Blank, Robert K. Trench: Speciation and Symbiotic Dinoflagellates. In: Science. 229, Nr. 4714, 1985, S. 656–658. doi:10.1126/science.229.4714.656.
- ↑ Scott R. Santos, Mary Alice Coffroth: Molecular genetic evidence that dinoflagellates belonging to the genus Symbiodinium freudenthal are haploid. In: The Biological Bulletin. 204, Nr. 1, Februar 2003, S. 10–20. doi:10.2307/1543491..
- ↑ Robert K. Trench: Nutritional potentials in Zoanthus sociathus (Coelenterata, Anthozoa). In: Helgoländer Wissenschaftliche Meeresuntersuchungen. 26, Nr. 2, 1974, S. 174–216. doi:10.1007/BF01611382.
Anmerkungen
- ↑ Für die Zooxanthellen wurde durch Karl Brandt 1881 der Gattungsname Zooxanthella vorgeschlagen, der trotz Warnungen vor der damit verbundenen Verwirrung (vgl. Rudolf J. Blank, Robert K. Trench: Nomenclature of Endosymbiotic Dinoflagellates. In: Taxon. 35, Nr. 2, Mai 1986, S. 286–294. doi:10.2307/1221270.) meist als taxonomisch valide anerkannt ist. Über seine Umschreibung herrscht keine Einigkeit. Einige Taxonomen betrachten dies als gültigen Namen der bisherigen Gattung Symbiodinium (vgl. Michael D. Guiry & Robert A. Andersen (2018): Validation of the generic name Symbiodinium (Dinophyceae, Suessiaceae) revisited and the reinstatement of Zooxanthella K.Brandt. Notulae algarum 58: 1–5.), diese Auffassung hat sich aber nicht durchgesetzt.
- ↑ Ein Multilocus-Genotyp ist die Kombination von Allelen, die an zwei oder mehr Stellen (lateinisch Loci) in einem einzelnen Individuum gefunden werden.
- ↑ Ein Klon oder klonale Linie ist eine Abstammungslinie genetisch identischer Individuen.
- ↑ Aposymbiose liegt vor, wenn symbiotische Organismen getrennt voneinander leben (z. B. ein Clownfisch, der unabhängig von einer Seeanemone lebt).
- ↑ a b Mucocysten oder Mucozysten sind zellmembrangebundene schleimabsondernde Organellen, d. h. eine spezielle Form von Extrusomen (Auswurforganellen).
- ↑ athecat oder athekat: ohne Theca (Hülle), daher auch „nackt“ genannt; siehe Dinoflagellaten §Merkmale.
- ↑ Zu Epikon/Epicon und Hypokon/Hypicon siehe Dinoflagellaten §Merkmale
- ↑ Sulcus: Längsfurche der Dinoflagellaten, siehe Dinoflagellaten §Merkmale.
- ↑ Cigulum oder Cingulum („Gürtel“): Querfurche der Dinoflagellaten, siehe Dinoflagellaten §Merkmale.
- ↑ Durch die Verschiebung im Cingulum entsteht bei vielen Dinoflagellaten ein längerer und engerer Sulcus, der wiederum eine stärkere Fraßströmung erzeugen kann.
- ↑ Obwohl das Protein-Produkt RuBisCO im Thylakoid/Chloroplast wirkt, ist es nicht dort im Plastom, sondern im Karyom des Zellkerns kodiert.