Tegument (Virus)
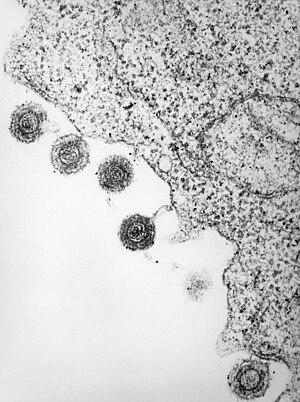
Ein Tegument (lateinisch tegumentum für Bedeckung, Haut) ist in der Virologie eine besondere Struktur des Viruspartikels (Virion) bei einigen behüllten Viren. Während sich normalerweise zwischen dem inneren Kapsid und der äußeren Virushülle nur eine zelluläre Flüssigkeit befindet (je nach Reifungsort der Viruspartikel Zytoplasma oder Kompartimentflüssigkeit des Endoplasmatisches Retikulums oder des Golgi-Apparates), ist dieser Raum bei einigen Viren mit viralen Proteinen angefüllt. Im Gegensatz zu Matrixproteinen, die strukturell mit der Innenseite der Virushülle verbunden sind, umkleidet das Tegument das Kapsid und wird beim Zusammenbau der Viruspartikel auch am Kapsid angelagert. Man kann ein inneres, sehr dicht gepacktes Tegument auf der Kapsid-Oberfläche, und ein äußeres, eher lose gepacktes Tegument zur Virushülle hin unterscheiden. Bei Betaherpesviren wurde am inneren Tegument ein von zwei besonders großen Tegumentproteinen gebildetes, ikosaedrisch angeordnetes Netz beschrieben.[1] In dieses sind die übrigen, kleineren Tegumentproteine eingelagert. Das Tegument ist für die typische „Spiegelei-Form“ der Herpesviren bei klassischen TEM-Abbildungen verantwortlich, da sie den Abstand zwischen Kapsid und Hülle verbreitern und bei der Präparation unterschiedlich stark Kontrastmittel einlagern. Dadurch tritt das Kapsid innerhalb des Virions auf TEM-Bildern besonders hervor.
Funktion
Am besten charakterisiert sind Tegumente bei den Herpesviridae. Eine genauere Darstellung der Proteinzusammensetzung gelang erstmals 1976 beim Epstein-Barr-Virus.[2] Die oft mehrere Dutzend verschiedenen Proteine, die das Tegument bilden, haben keine morphologische Funktion, sie sind vielmehr in der Frühphase der Virusvermehrung unmittelbar nach Entfernung der Hülle (Uncoating) und Eintritt das Kapsids in das Zytoplasma für eine Vielzahl unterschiedlicher Steuerungsprozesse verantwortlich. Da die Tegumentproteine sofort nach Eintritt des Virus verfügbar sind und nicht erst nachdem sie im Laufe der viralen Replikation synthetisiert wurden, können sie im Zytoplasma beispielsweise sofort die Erkennung der PAMPs unterdrücken und damit die zelluläre Abwehr gegen eine Virusinfektion unterdrücken. Einige Tegumentproteine dienen der Ausschaltung zellulärer Synthesewege und damit der Vorbereitung der Übernahme durch die Virusreplikation (viral host shut-off, vhs-Proteine). Sie greifen durch Bindung an zelluläre Transkriptionsfaktoren spezifisch in die zelluläre Genexpression und Transkription ein. Tegumentproteine können auch bei der Steuerung der viralen Genexpression oder dem Übergang in ein Latenzstadium als virale cccDNA innerhalb des Zellkerns mitwirken, ebenso beim Zusammenbau der Kapside, dem Transport zum Zellkern (Kerntransport) und zum Golgi-Apparat, der Modifikation des Zytoskeletts und der Knospung und Reifung der Virionen.[3]
Entstehung des Teguments
Die Kapside von Herpesviren erhalten eine primäre Virushülle nach einer Knospung an der Kernmembran. Diese unreifen Partikel befinden sich dann in der perinukleären Zisterne und besitzen noch kein Tegument. Nach erneuter Fusion mit der äußeren Kernmembran und Eintritt in das Zytoplasma verliert das Partikel diese Hülle, worauf nach der Synthese der Tegumentproteine diese an das nackte Kapsid angelagert werden. Durch erneutes Knospen an der Membran des Golgi-Apparat erhält das Tegument-umkleidete Kapsid seine endgültige Virushülle.[4]
Einzelnachweise
- ↑ X. Yu et al.: Biochemical and structural characterization of the capsid-bound tegument proteins of human cytomegalovirus. J. Struct. Biol. (2011) 174(3): S. 451–460 PMID 21459145
- ↑ M. Dolyniuk et al.: Proteins of Epstein-Barr Virus. II. Electrophoretic analysis of the polypeptides of the nucleocapsid and the glucosamine- and polysaccharide-containing components of enveloped virus. J. Virol. (1976) 18(1): S. 289–297 PMID 176465
- ↑ B. J. Kelly et al.: Functional roles of the tegument proteins of herpes simplex virus type 1. Virus Res. (2009) 145(2): S. 173–186. PMID 19615419
- ↑ H. Guo et al.: Role of tegument proteins in herpesvirus assembly and egress. Protein Cell. (2010) 1(11): S. 987–998 PMID 21153516