Thorium(IV)-carbid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Th4+ _ C4− | ||||||||||
| Kristallsystem |
kubisch | |||||||||
| Raumgruppe |
Fm3m (Nr. 225) | |||||||||
| Allgemeines | ||||||||||
| Name | Thorium(IV)-carbid | |||||||||
| Andere Namen |
Thoriummonocarbid | |||||||||
| Verhältnisformel | ThC | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 244,049 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
10,67 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Thorium(IV)-carbid (ThC) ist eine chemische Verbindung des Thoriums in der Oxidationsstufe +4 mit Kohlenstoff, vorliegend als Methanid (C4−). Durch den Elektronegativitätsunterschied der Elemente von 1,25 auf der Pauling-Skala haben die Bindungen grob 30 % ionischen Charakter.
Gewinnung und Darstellung
Thorium(IV)-carbid kann durch Reaktion von Thorium mit Kohlenstoff gewonnen werden.[3]
Eigenschaften
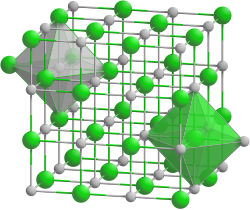
Thorium(IV)-carbid ist ein schwarzgraue, metallisch glänzende, kristalline Substanz, die mit Wasser und verdünnten Säuren unter Bildung von Kohlenwasserstoffen reagiert. Er hat eine kubische Kristallstruktur vom Natriumchlorid-Typ mit Homogenitätsgebiet (a = 529–536 pm) mit der Raumgruppe Fm3m (Nr. 225)[1] und einen hohen Schmelzpunkt und ist wie alle Thoriumverbindungen radioaktiv.
Verwandte Verbindungen
- Thoriumdicarbid (ThC2)
Einzelnachweise
- ↑ a b c d W. Martienssen, Hans Warlimont: Springer Handbook of Condensed Matter and Materials Data. Springer, 2005, ISBN 3-540-44376-2, S. 462 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1083, 1158.
