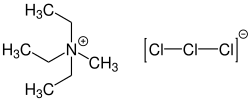
Triethylmethylammoniumtrichlorid
| Strukturformel | |||
|---|---|---|---|
| |||
| Allgemeines | |||
| Name | Triethylmethylammoniumtrichlorid | ||
| Summenformel | C7H18Cl3N | ||
| Kurzbeschreibung |
gelbe Flüssigkeit[1] | ||
| Externe Identifikatoren/Datenbanken | |||
| |||
| Eigenschaften | |||
| Molare Masse | 222,58 g·mol−1 | ||
| Aggregatzustand |
flüssig[1] | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Triethylmethylammoniumtrichlorid ist eine ionische Flüssigkeit, die aus dem unsymmetrischen Triethylmethylammonium-Kation und einem Trichlorid-Anion besteht. Das Trichlormonoanion zählt damit zu einem der einfachsten Vertreter von Polychloranionen.[3]
Darstellung
Ähnlich wie andere Trichloride (z. B. Tetraethylammoniumtrichlorid) wird Triethylmethylammoniumtrichlorid durch Reaktion von Triethylmethylammoniumchlorid und elementarem Chlor dargestellt.
Das dabei entstehende Triethylmethylammoniumtrichlorid ist bei Raumtemperatur eine gelbe, ionische Flüssigkeit.[1]
Struktur und Bindungssituation
Die Bindungsverhältnisse im Trichlorid-Anion können als Halogenbindung zwischen einem Chlorid-Anion (dem Halogendonor) und einem Dichlor-Molekül (dem Halogenakzeptor) aufgefasst werden. Dabei doniert das Chlorid-Anion formell Elektronendichte in das σ-Loch des Dichlormoleküls, das entlang der Chlor-Chlor-Achse liegt. Es entsteht das Trichlorid ([Cl–Cl–Cl]−), das nun als Donor-Akzeptor-Komplex mit einer 3Z-4E-Bindung (siehe Mehrzentrenbindung) beschrieben werden kann und theoretisch eine lineare Struktur mit gleich langen Cl-Cl-Bindungen hat.[4] Durch Wechselwirkungen des Trichlorid-Anions mit den Kationen und Packungseffekten im Feststoff weicht die reelle Struktur des Trichlorid-Anions in der Regel von der theoretischen Struktur ab.[3]
Exakter wird Triethylmethylammoniumtrichlorid mit der Summenformel [NEt3Me][Cl(Cl2)n] beschrieben, wobei n für die gebundenen Äquivalente Chlor steht. Bei n = 0 ist kein Chlor gebunden und es liegt das Chloridsalz, [NEt3Me]Cl, vor. Durch Zugabe von elementarem Chlor wächst n, wobei diverse Polychloride durchlaufen werden. Bei n = 1 kann die Verbindung als Trichlorid, [NEt3Me][Cl3], aufgefasst werden, bei n = 2 als das entsprechende Pentachlorid [NEt3Me][Cl5]. Darüber werden höhere Polychloride gebildet. Bei n < 0,8 ist [NEt3Me][Cl(Cl2)n] bei Raumtemperatur fest; bei n > 0,8 ist es flüssig.[3][1]
Verwendung
Die Reaktivität von Triethylmethylammoniumtrichlorid ähnelt der von Tetraethylammoniumtrichlorid oder elementarem Chlor, allerdings ergeben sich gegenüber Chlorgas präparative Vorteile daraus, dass Triethylmethylammoniumtrichlorid bei Raumtemperatur als Flüssigkeit vorliegt und so besser gehandhabt werden kann. Triethylmethylammoniumtrichlorid reagiert mit Alkenen unter Chlorierung der Doppelbindung zu den entsprechenden vicinalen Dichloralkanen. Darüber hinaus reagiert Triethylmethylammoniumtrichlorid mit Kohlenstoffmonoxid zu Phosgen bei Raumtemperatur und ohne weitere Aktivierung mit Licht, wie es bei der Reaktion von Kohlenstoffmonoxid mit elementarem Chlor erforderlich ist (siehe Phosgen). In Gegenwart von elementarem Chlor kann dieselbe Reaktion auch mit katalytischen Mengen [NEt3Me]Cl durchgeführt werden; hierbei wird vermutlich [NEt3Me][Cl3] als katalytisch aktive Spezies durchlaufen, die mit Kohlenstoffmonoxid zu Phosgen reagiert und dabei wieder [NEt3Me]Cl bildet.[1]
![{\displaystyle {\ce {[NEt3Me]Cl + Cl2 -> [NEt3Me][Cl3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b211e0aecc91992c9ba285dbb707dc4fd76a97e)

![{\displaystyle {\ce {[NEt3Me][Cl3] + CO -> COCl2 + [NEt3Me]Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6ce3a829c2e60edfaa6bcd870610056cbdba04a)