Uranylcarbonat
| Kristallstruktur | |||||||||
|---|---|---|---|---|---|---|---|---|---|
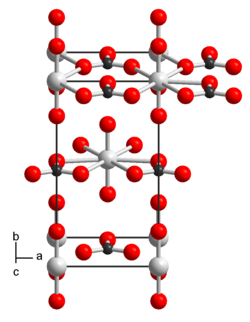
| |||||||||
| _ U _ C _ O | |||||||||
| Allgemeines | |||||||||
| Name | Uranylcarbonat | ||||||||
| Verhältnisformel | (UO2)CO3 | ||||||||
| Kurzbeschreibung |
grünlich-gelber Feststoff[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 330,037 g·mol−1 | ||||||||
| Aggregatzustand |
fest | ||||||||
| Löslichkeit |
nicht löslich in Wasser[2] | ||||||||
| Gefahren- und Sicherheitshinweise | |||||||||
 Radioaktiv | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Uranylcarbonat, ((UO2)CO3) ist das grünlich-gelbe Uranylsalz der Kohlensäure.
Vorkommen
Uranylcarbonat kommt als Mineral Rutherfordin in der Natur vor. Des Weiteren kommen in der Natur weitere carbonathaltige Uranylminerale vor, unter anderem zum Beispiel Albrechtschraufit (Ca4Mg(UO2)2(CO3)6F2 · 17 H2O), Andersonit (Na2Ca[(UO2)(CO3)3](H2O)5), Astrocyanit (Cu2(Ce,Nd,La)2UO2(CO3)5(OH)2 · 1,5 H2O) und Liebigit (Ca2UO2(CO3)3 · 11 H2O).[6]
Darstellung
Die Uranylcarbonate werden hauptsächlich in basischem Milieu bei hohen CO2-Partialdrücken gebildet, da es im sauren Bereich durch Kohlenstoffdioxidfreisetzung zu keiner Komplexierung kommen kann.[6]
Uranylcarbonat kann durch Erhitzen einer Mischung von Urantrioxid mit Kohlenstoffdioxid in Wasser bei einer Temperatur von 300 °C dargestellt werden.[7]
Eigenschaften
Wasserfreies Uranylcarbonat ist stabil bis 500 °C.[8] In wässrigen Lösungen bilden sich bei geringer Hydroxidionen-Konzentration anionische Tricarbonat-Komplexe mit dem [UO2(CO3)3]4−-Ion.[6] Neben dem Tricarbonat-Komplex konnte auch noch der Dicarbonatkomplex [UO2(CO3)2]2− im Festkörper und in Lösung nachgewiesen werden. Darüber hinaus findet sich in Lösung auch der trimere Komplex [(UO2)3(CO3)6]6−, wobei die einzelnen Spezies stark vom pH-Wert abhängig sind.[9]
Gesundheits- und Umweltgefahren
Uranylcarbonat ist wie alle Uranverbindungen radioaktiv und sollte daher mit der entsprechenden Vorsicht behandelt und eine Aufnahme in den Körper vermieden werden.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium. In: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 253–698, doi:10.1007/1-4020-3598-5_5.
Einzelnachweise
- ↑ G. Meinrath, T. Kimura: Carbonate complexation of the uranyl(VI) ion. In: Journal of Alloys and Compounds. Band 202, Nr. 1–2, 10. Dezember 1993, S. 89–93, doi:10.1016/0925-8388(93)90523-P.
- ↑ Chinh Nguyen Trung, G. M. Begun, Donald A. Palmer: Aqueous uranium complexes. 2. Raman spectroscopic study of the complex formation of the dioxouranium(VI) ion with a variety of inorganic and organic ligands. In: Inorganic Chemistry. Band 31, Nr. 25, 1. Dezember 1992, S. 5280–5287, doi:10.1021/ic00051a021.
- ↑ Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ a b c Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, S. 261.
- ↑ Eugene. Staritzky, D. T. Cromer: Crystallographic Data. 130. Uranyl Carbonate, UO2CO3. In: Analytical Chemistry. Band 28, Nr. 7, 1. Juli 1956, S. 1211, doi:10.1021/ac60115a053.
- ↑ Balaram Sahoo, D. Patnaik: Carbonates of Uranium. In: Nature. Band 185, Nr. 4714, 5. März 1960, S. 683, doi:10.1038/185683a0 (Letters to Nature, „Leserbriefe“).
- ↑ W. A. de Jong, E. Apra, T. L. Windus, J. A. Nichols, R. J. Harrison, K. E. Gutowski, D. A. Dixon: Complexation of the Carbonate, Nitrate, and Acetate Anions with the Uranyl Dication: Density Functional Studies with Relativistic Effective Core Potentials. In: The Journal of Physical Chemistry A. Band 109, Nr. 50, 1. Dezember 2005, S. 11568–11577, doi:10.1021/jp0541462.




