Urocanase
| Urocanase | ||
|---|---|---|

| ||
| Urocanase dimer, Bacillus subtilis | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 676 Aminosäuren | |
| Kofaktor | NAD | |
| Bezeichner | ||
| Gen-Name | UROC1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.2.1.49, Lyase | |
| Reaktionsart | Gleichgewichtsreaktion | |
| Substrat | Urocanat + Wasser | |
| Produkte | Hydroxy-Imidazol-Propionat | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 131669 | 243537 |
| Ensembl | ENSG00000159650 | ENSMUSG00000034456 |
| UniProt | Q96N76 | Q8VC12 |
| Refseq (mRNA) | NM_144639 | NM_144940 |
| Refseq (Protein) | NP_65324 | NP_659189 |
| Genlocus | Chr 12: 126.48 – 126.52 Mb | Chr 6: 90.33 – 90.36 Mb |
| PubMed-Suche | 131669 | 243537
|
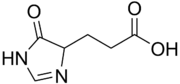
Urocanase (auch Urocanat-Hydratase) ist ein Enzym, das am Abbau der Aminosäure Histidin beteiligt ist und dort den zweiten Schritt, die Hydratation von Urocanat zu Hydroxy-Imidazol-Propionat katalysiert. Es ist bei Wirbeltieren in der Leber zu finden, kommt aber auch in manchen Bakterien und Pflanzen vor. Mutationen im UROC1-Gen können die seltene Erbkrankheit Urocanasemangel verursachen.[1][2]
Katalysierte Reaktion
Urocansäure (links) wird in Hydroxy-Imidazol-Propionat (rechts) umgesetzt.
Aufbau
Urocanase ist ein Homodimer aus 2 * 557 Aminosäuren mit einer molekularen Masse von 2 * 61 kDa. Beide Untereinheiten enthalten jeweils ein NAD+-Molekül als festen, aber nicht kovalent gebundenen Kofaktor. Eine Untereinheit besteht aus einer NAD+-bindenden Domäne und einer Kerndomäne, welche auch die Bindungsstelle zur anderen Untereinheit enthält.
Literatur
- Berg/Tymoczko/Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6
Einzelnachweise
- ↑ UniProt Q96N76
- ↑ PROSITE documentation PDOC00947. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).