Vanadium(II)-oxid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ V2+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Vanadium(II)-oxid | ||||||||||||
| Verhältnisformel | VO | ||||||||||||
| Kurzbeschreibung |
geruchloser grauer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 66,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
5,76 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
2627 °C[4] | ||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vanadium(II)-oxid ist eine anorganische chemische Verbindung des Vanadiums aus der Gruppe der Oxide.
Gewinnung und Darstellung
Vanadium(II)-oxid kann durch Reaktion von Vanadium(III)-oxid mit Vanadium im Vakuum bei Temperaturen zwischen 1200 und 1600 °C gewonnen werden.[3]
Eigenschaften
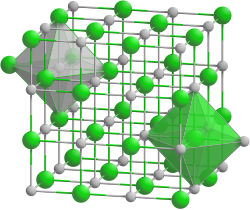
Vanadium(II)-oxid ist ein geruchloses graues Pulver und hat einen Homogenitätsbereich von VO0,86 bis VO1,25. Nach verschiedenen Autoren besteht es wahrscheinlich aus zwei benachbarten Phasen VO0,86 bis VO0,91 und VO1,05 bis VO1,25. Es besitzt eine Kristallstruktur vom Natriumchlorid-Typ (a = 402,7–413,8 pm),[3] also eine kubische Kristallstruktur mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225).[5] Es ist löslich in Säuren, wobei sich V(H2O)62+ Ionen bilden, die die Lösung violett färben. Diese Lösungen wirken als starke Reduktionsmittel, wobei sich die Ionen an Luft schnell zu V(H2O)63+ Ionen umsetzen, was an einem Farbumschlag der Lösung zu grün sichtbar ist.[6]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Vanadium(II) oxide, 99+% (metals basis) bei AlfaAesar, abgerufen am 16. Juni 2013 (PDF) (JavaScript erforderlich).
- ↑ W. M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics 2012-2013. CRC Press, 2012, ISBN 978-1-4398-8049-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1419.
- ↑ Periodensystem online: Eigenschaften von Vanadium(II)oxid
- ↑ Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 790 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gurdeep Raj: Advanced Inorganic Chemistry. Vol. 1, 1975, ISBN 81-87224-03-7, S. 925 (eingeschränkte Vorschau in der Google-Buchsuche).


