Zinkfluorid
| Kristallstruktur | ||||||||
|---|---|---|---|---|---|---|---|---|
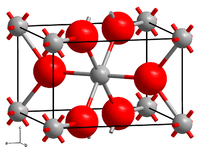
| ||||||||
| _ Zn2+ _ F− | ||||||||
| Allgemeines | ||||||||
| Name | Zinkfluorid | |||||||
| Andere Namen |
Zink(II)-fluorid | |||||||
| Verhältnisformel | ZnF2 | |||||||
| Kurzbeschreibung |
durchsichtige, monokline Kristalle[1] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 103,27 g·mol−1 | |||||||
| Aggregatzustand |
fest | |||||||
| Dichte |
4,95 g·cm−3[2] | |||||||
| Schmelzpunkt | ||||||||
| Siedepunkt |
1500 °C[3] | |||||||
| Löslichkeit | ||||||||
| Brechungsindex |
1,502[3] | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||
Zinkfluorid ist eine chemische Verbindung von Zink und Fluor aus der Gruppe der Halogenide.
Gewinnung und Darstellung
Zinkfluorid kann durch direkte Reaktion von Zink mit Fluor[6] oder durch Reaktion von Fluorwasserstoff mit Zink unter Entstehung von Wasserstoff (H2) gewonnen werden.[6] Es kommt auch als Tetrahydrat vor. Alternativ ist auch die Gewinnung aus Fluorwasserstoff und Zinkcarbonat möglich.[4]
Eigenschaften
Zinkfluorid hat eine Rutil-Kristallstruktur (Raumgruppe P42/mnm (Raumgruppen-Nr. 136)) mit sechs Zinkatomen was (im Gegensatz zu den anderen Zinkhalogeniden) zu einer ionischen Bindung und der schlechten Löslichkeit in Wasser führt.[6] Zinkfluorid hydrolysiert in heißem Wasser zu Zinkhydroxidfluorid Zn(OH)F.[7]
Verwendung
Zinkfluorid dient als Holzschutzmittel[8] und kann zur Herstellung von anderen Fluorverbindungen wie Phosphortrifluorid verwendet werden.
Literatur
- R. Leckebusch, K. Recker: Farbzentren-Untersuchungen an Zinkfluorid-Einkristallen. In: Die Naturwissenschaften. 56, 1969, S. 511, doi:10.1007/BF00601966.
- A. G. Banshchikov; N. F. Kartenko; A. K. Kaveev; M. M. Moisseeva; Nikolai S. Sokolov: Growth and structural characterization of ZnF2 epitaxial layers on Si. SPIE 5023, 10th International Symposium on Nanostructures: Physics and Technology, (11 June 2003); doi:10.1117/12.510497.
Einzelnachweise
- ↑ Eintrag zu Zinkfluorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c d Datenblatt Zinc fluoride bei Sigma-Aldrich, abgerufen am 15. Mai 2017 (PDF).
- ↑ a b Jean de Ans, Ellen Lax: Taschenbuch Für Chemiker Und Physiker: Band 3: Elemente, Anorganische ... Springer DE, 1998, ISBN 3-540-60035-3, S. 810 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6.
- ↑ Datenblatt Zinkfluorid (Tetrahydrat) bei AlfaAesar, abgerufen am 15. August 2010 (PDF) (JavaScript erforderlich).
- ↑ a b c Norman N. Greenwood, A. Earnshaw: Chemistry of the Elements. 2. Auflage, Butterworth-Heinemann, Oxford 1997, ISBN 0-7506-3365-4.
- ↑ O. K. Srivastava, E. A. Secco: Studies on metal hydroxy compounds. I. Thermal analyses of zinc derivatives ε-Zn(OH)2, Zn5(OH)8Cl2·H2O, β-ZnOHCl, and ZnOHF. In: Canadian Journal of Chemistry. 45 (6), 1967, S. 579–583, doi:10.1139/v67-096.
- ↑ Erwin Riedel: Anorganische Chemie.


