Zinkcarbonat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
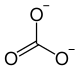
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Zinkcarbonat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | ZnCO3 | ||||||||||||
| Kurzbeschreibung |
farbloser bis gelblicher, geruchloser Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 125,42 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
4,43 g·cm−3[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (10 mg·l−1 bei 15 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−812,8 kJ/mol[4] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Zinkcarbonat ist in der Chemie ein Zinksalz der Kohlensäure (Carbonate).
Vorkommen
In der Natur kommt Zinkcarbonat als Smithsonit (Zinkspat) vor.
Gewinnung und Darstellung
Zinkcarbonat mit der chemischen Zusammensetzung ZnCO3 entsteht als weißer Niederschlag bei der Vereinigung von Zinksalz- und Soda-Lösung.
Es entsteht ebenfalls bei der Reaktion von Zinksalzen mit Kaliumhydrogencarbonat.[5]
Eigenschaften
Es handelt sich um ein weißes, in Säuren lösliches Pulver, das beim Glühen in Zinkoxid überführt werden kann (Brennen unter Abspaltung von Kohlenstoffdioxid):
In starken Laugen kann Zinkcarbonat komplex als farbloses Tetrahydroxozinkat gelöst werden (Komplexbildungsreaktion). Es kristallisiert im trigonalen Kristallsystem und entwickelt meist rhomboedrische Kristalle in überwiegend blauer oder grüner Farbe (auch farblose, weiße, lichtgelbe oder braune Kristalle sind bekannt). Chemisch gesehen ähneln die Eigenschaften von Zinkcarbonat denen des Kalks (Calciumcarbonat), jedoch bilden Zink-II-Salzlösungen im Unterschied zu Calciumverbindungen Sulfid-Niederschläge, jedoch keine Niederschläge bei Zugabe von Schwefelsäure. Wässrige Suspensionen von Zinkcarbonat reagieren alkalisch.
Verwendung
Zinkcarbonat wird als Pigment verwendet und ist in pharmazeutischen Zubereitungen enthalten. Es wird weiterhin zur Herstellung von Zinkoxid-Pigmenten, für die Absorption von Schwefelwasserstoff bei der Spülung von Tiefbohrungen und in der Textilfärberei/Textildruck verwendet. Daneben wird es als Aktivator für die Schwefel- und Thiuramvulkanisation von transluzenten und semitransparenten Gummiartikeln, als Vulkanisiermittel in carboxylierten Kautschuken und Aktivator in Latextauchartikeln verwendet.[6]
Der Schutz vor Korrosion, den eine Feuerverzinkung bietet, beruht auf der Bildung schützender Deckschichten, die durch Witterungseinflüsse im Verlaufe der Zeit auf der Oberfläche feuerverzinkter Stahlteile entstehen. Diese Deckschichten bestehen überwiegend aus Zinkcarbonat.[7]
Siehe auch
- Zinkhydroxidcarbonat (Basisches Zinkcarbonat), [ZnCO3]2·[Zn(OH)2]3, CAS-Nummer: 5263-02-5
- Dizinkcarbonat Zn2CO3
Einzelnachweise
- ↑ Eintrag zu ZINC CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d e Eintrag zu Zinkcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ H. Effenberger, K. Mereiter, J. Zemann: Crystal structure refinements of magnesite, calcite, rhodochrosite, siderite, smithonite, and dolomite, with discussion of some aspects of the stereochemistry of calcite type carbonates. In: Zeitschrift für Kristallographie. Band 156, Nr. 3-4, 1981, S. 233–243, doi:10.1524/zkri.1981.156.3-4.233.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1035.
- ↑ brueggemann.com: Zinkcarbonat.
- ↑ Arbeitsblätter Feuerverzinken: Lagern und Transportieren von feuerverzinktem Stahl.



