Zinknitrat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Zn2+ 2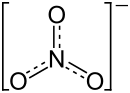
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinknitrat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | Zn(NO3)2 | |||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 189,39 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,065 g·cm−3 (Hexahydrat, 20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser[2] (1843 g·l−1 bei 20 °C, Hexahydrat)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Zinknitrat [Zn(NO3)2] ist das Zinksalz der Salpetersäure.
Gewinnung und Darstellung
Wasserhaltiges Zinknitrat entsteht bei der Reaktion von Zink mit Salpetersäure.
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{ Zn + 2\ HNO_{3\ (aq)} + 6H_2O \longrightarrow Zn(NO_3)_2 \cdot 6\ H_2O + H_2\uparrow }}
Dagegen lässt sich wasserfreies Zinknitrat nicht auf diese Weise gewinnen. Stattdessen ist es möglich, dieses durch Reaktion von Distickstofftetroxid und Zink zu erhalten.
Eigenschaften
Zinknitrat ist ein farbloser brandfördernder Feststoff. Er zersetzt bei Erhitzung, wobei Stickoxide und Zinkoxid entstehen und vorher oberhalb von 105 °C Kristallwasser abgegeben wird.[2]
Von Zinknitrat sind mehrere Salze mit unterschiedlichen Mengen Kristallwasser bekannt. Das bekannteste enthält sechs Äquivalente Wasser (Hexahydrat), bekannt sind aber auch Hydrate mit zwei, vier oder neun Wassermolekülen.
Verwendung
Zinknitrat wird als Katalysator beim Knitterfestmachen von Textilwaren, als Bestandteil von Latex-Koagulierungsbädern, in der Galvanotechnik und der Acetatfaserfärbung verwendet.[2]
Es findet Verwendung als Bleich- und Beizmittel, sowie zur Gewinnung anderer Zinkverbindungen.
Einzelnachweise
- ↑ Eintrag zu ZINC NITRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i Eintrag zu Zinknitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Februar 2017. (JavaScript erforderlich)
- ↑ a b H. Schmit, C. Rathgeber, P. Hennemann, S. Hiebler: Three–step method to determine the eutectic composition of binary and ternary mixtures - Tested on two novel eutectic phase change materials based on salt hydrates. In: J. Therm. Anal. Calorim. 117, 2014, S. 595–602.
- ↑ applichem: Zinknitrat-Hexahydrat

