Zirconium(IV)-bromid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Zr4+ _ Br− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zirconium(IV)-bromid | |||||||||||||||
| Andere Namen |
Zirconiumtetrabromid | |||||||||||||||
| Verhältnisformel | ZrBr4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 410,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
4,201 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Zirconium(IV)-bromid ist eine anorganische chemische Verbindung des Zirconiums aus der Gruppe der Bromide.
Gewinnung und Darstellung
Zirconium(IV)-bromid kann durch Bromierung von Zirconium mit Brom bei 380 °C gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Zirconium(IV)-oxid mit Kohlenstoff und Brom.[3]
Eigenschaften
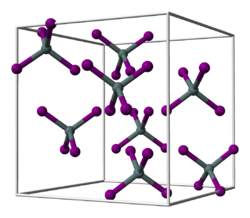
Zirconium(IV)-bromid ist ein weißer Feststoff. Bei Einwirkung von Wasser hydrolysiert er vollständig zu Zirconiumoxybromid. Seine Kristallstruktur entspricht der von Zinn(IV)-iodid mit der Raumgruppe Pa3 (Raumgruppen-Nr. 205). Er sublimiert bei 357 °C.[1]
Verwendung
Durch Reduktion mit Zirconium oder Aluminium kann Zirconium(III)-bromid gewonnen werden.[4]
Einzelnachweise
- ↑ a b Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 818 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f Datenblatt Zirconium(IV) bromide, anhydrous, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 4. Mai 2013 (PDF).
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1358.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1354ff.




