Gallium(I,III)-chlorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
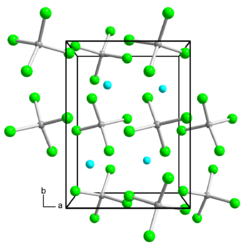
| ||||||||||
| _ Ga+ _ Ga3+ _ Cl− | ||||||||||
| Kristallsystem |
tetragonal | |||||||||
| Gitterparameter |
a = 7,2235 Å, b = 9,7211 Å, c = 9,5421 Å | |||||||||
| Allgemeines | ||||||||||
| Name | Gallium(I,III)-chlorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | GaCl2 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 140,62 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
2,42 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gallium(I,III)-chlorid ist eine anorganische chemische Verbindung des Galliums aus der Gruppe der Chloride.
Gewinnung und Darstellung
Gallium(I,III)-chlorid kann durch Reaktion von Gallium mit Gallium(III)-chlorid bei 180 °C unter Ausschluss von Feuchtigkeit gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Gallium mit heißer Salzsäure.[5]
Eigenschaften
Gallium(I,III)-chlorid ist ein farbloser hygroskopischer Feststoff, der löslich in Benzol ist und Verwendung als starkes Reduktionsmittel findet[3]. Er liegt in kristalliner Form und in der Schmelze als Ga[GaCl4] vor.[1] In geschmolzener Form leitet die Verbindung elektrischen Strom[6] und benetzt Glas nicht[3]. Langsames Abkühlen der sauberen Schmelze führt zu einer unterkühlten Schmelze, die auch bei Raumtemperatur über Jahre flüssig sein kann.[3] Die Gitterkonstanten der tetragonalen Elementarzelle lauten a = 7,2235 Å, b = 9,7211 Å, c = 9,5421 Å.[7]
Einzelnachweise
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 853.
- ↑ Egon Wiberg, Nils Wiberg: Inorganic Chemistry. Academic Press, 2001, ISBN 0-12-352651-5, S. 1036 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Laurence S. Foster: Gallium(II) chloride. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, S. 111–114 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. Chand: Advanced Inorganic Chemistry. 2000, ISBN 81-219-0263-0, S. 801 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Singh: Chemistry Of D-Block Elements. Discovery Publishing House, 2007, ISBN 81-8356-242-6, S. 61 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. P. Wilkinson; A. K. Cheetham: Study of oxidation‐state contrast in gallium dichloride by synchrotron X‐ray anomalous scattering. In: Acta Crystallographica Section B. Band 47, Nr. 2, April 1991, S. 155–161, doi:10.1107/S0108768190010485 (englisch).

