Chlorameisensäurebenzylester
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlorameisensäurebenzylester | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H7ClO2 | |||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 170,60 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,22 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
178–180 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung mit Wasser[2] | |||||||||||||||
| Brechungsindex |
1,5190 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Chlorameisensäurebenzylester, auch Benzylchlorformiat, korrekt als Chlorkohlensäurebenzylester zu bezeichnen, ist eine chemische Verbindung aus der Stoffgruppe der Chlorameisensäureester. Bei der Synthese von Peptiden dient Benzylchlorformiat als Reagenz zur Einführung der Benzyloxycarbonyl-Gruppe, die meist als Schutzgruppe für Aminogruppen eingesetzt wird.
Eigenschaften
Benzylchlorformiat ist eine stechend und erstickend riechende, tränenreizende Flüssigkeit. Sie ist in den meisten organischen Lösungsmitteln löslich, wird aber durch protische Lösungsmittel wie Wasser oder Alkohole solvolytisch zersetzt. Mit Alkoholen bilden sich Kohlensäureester. Mit Aminen reagiert Benzylchlorformiat zu Urethanen.
Herstellung
Im Labor durch Zutropfen von Benzylalkohol zu flüssigem Phosgen bei etwa −20 °C, wobei der Benzylalkohol im Unterschuss zugegeben wird, um die Bildung des Diesters zu minimieren.[5] Alternativ kann das Phosgen auch in Toluol oder DMF gelöst werden, wobei diese Lösemittel bei Folgereaktionen stören können.
Verwendung
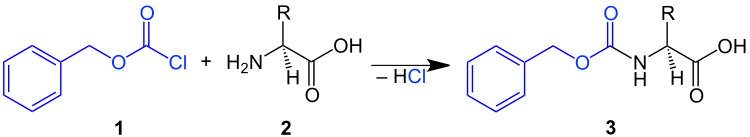
In der organischen Synthesechemie und besonders in der Peptidsynthese wird die Benzyloxycarbonylgruppe mit Benzylchlorformiat in Gegenwart einer schwachen Base eingeführt. Die Cbz-Gruppe lässt sich zum Schützen einer Aminogruppe einfach in ein Molekül einführen, indem das Amin (z. B. die Aminosäure 2) mit Benzyloxycarbonylchlorid 1 in Gegenwart einer schwachen Base umgesetzt wird. Dabei entsteht eine Cbz-geschützte Aminosäure 3:[6]
Das geschützte Amin (z. B. in 3) kann durch katalytische Hydrierung unter hydrogenolytischer Spaltung der Benzyl-Heteroatom-Bindung mit anschließender Decarboxylierung der so entstehenden instabilen Carbaminsäure oder Behandlung mit Säuren wieder entschützt werden.
Nomenklatur
Der gebräuchliche Name „Chlorameisensäurebenzylester“ ist nicht korrekt, da die Verbindung kein Derivat der Ameisensäure, sondern der Kohlensäure (Kohlensäuremonochlorid und Kohlensäuremonoester) ist.[7]
Gefahrenhinweise
Da sich Benzylchlorformiat durch Luftfeuchtigkeit und auf der Haut hydrolytisch unter Bildung von Salzsäure zersetzt, wirkt es bei Kontakt stark ätzend. Eingeatmet kann es zu Lungenödemen führen.
Kommerziell erhältliches Benzylchlorformiat enthält herstellungsbedingt das als krebserregend eingestufte Benzylchlorid als Verunreinigung. Einige Hersteller, beispielsweise die Merck KGaA, bezeichnen daher auch das Benzylchlorformiat als krebserregend und geben zusätzlich das GHS-Piktogramm 08 (gesundheitsgefährdend) neben den H-Sätzen 314‐335‐350‐410 und den P-Sätzen 201‐273‐280‐301+330+331‐305+351+338‐308+310 an.[1]
Siehe auch
- Alloc (Allyloxycarbonyl-Gruppe)
Literatur
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Oxford University Press, 2001
Einzelnachweise
- ↑ a b c Datenblatt Benzylchlorformiat (stabilisiert) zur Synthese bei Merck, abgerufen am 1. Februar 2018.
- ↑ a b c d e f Eintrag zu Benzylchlorformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-42.
- ↑ Eintrag zu Benzyl chloroformate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ L. Hough, J. E. Priddle: 621. Carbonate derivatives of methyl α-D-mannopyranoside and of D-mannose. In: Journal of the Chemical Society. 1961, S. 3178–3181, doi:10.1039/JR9610003178.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 661, ISBN 3-342-00280-8.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 430 (eingeschränkte Vorschau in der Google-Buchsuche).