Kupfer(II)-sulfid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Cu2+ _ S2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kupfer(II)-sulfid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | CuS | |||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 95,61 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (0,33 mg l−1, 18 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,1 mg·m−3 [1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kupfer(II)-sulfid ist eine chemische Verbindung des Kupfers und Schwefels. Es ist ein schwarzer, spröder Feststoff mit der Verhältnisformel CuS. Trotz dieser Verhältnisformel liegen in der Verbindung nicht nur Cu2+-Ionen vor, sondern sie besteht aus einer Mischung von Cu+- und Cu2+-Ionen sowie Sulfidionen und Disulfidionen. Das genaue Verhältnis ist Cu2ICuII(S2)S.[3]
Vorkommen
In der Natur kommt Kupfer(II)-sulfid als das Mineral Covellin vor.
Gewinnung und Darstellung
Kupfer(II)-sulfid wird (im Labor) durch Fällung aus wässriger Lösung dargestellt, beispielsweise durch Einleiten von Schwefelwasserstoff.[4]
Hochreines Kupfer(II)-sulfid erhält man durch Reaktion einer Kupfer(I)-sulfid/Schwefel-Mischung bei Raumtemperatur.[4]
Eigenschaften
Physikalische Eigenschaften
Kupfer(II)-sulfid ist ein schwarzer, wasserunlöslicher Feststoff, der in der Natur als sulfidisches Kupfererz vorkommt. Er ist elektrisch leitfähig. In feuchter Luft wird das Erz Kupfer(II)-sulfid zu Kupfersulfat oxidiert. In trockener Luft bei Raumtemperatur ist die Verbindung stabil. Wird Kupfer(II)-sulfid unter Luftausschluss erhitzt, zerfällt es bei 507 °C zu Kupfer(I)-sulfid und Schwefel. Das entstandene Kupfersulfid ist aber nicht stöchiometrisch aufgebaut und lässt sich durch die Form Cu2-xS besser beschreiben.[2]
Das Rösten des Erzes an Luft führt hingegen zu Kupfer(II)-oxid und Schwefeldioxid.
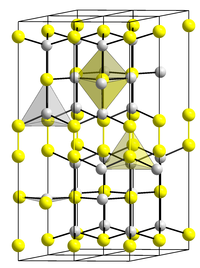
Kupfer(II)-sulfid hat eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) (a = 3,794 Å, c = 16,33 Å) und eine Bildungsenthalpie von −48,5 kJ/mol.[4]
Chemische Eigenschaften
Kupfer(II)-sulfid ist löslich nur in konzentrierten, oxidierenden Säuren. Beispielsweise reagieren 3 mol CuS mit 8 mol konz. Salpetersäure zu Kupfersulfat (3 mol), Stickstoffmonoxid (8 mol) und Wasser (Redoxreaktion). In verdünnten Säuren ist es unlöslich. Im Kationentrenngang wird es daher schon bei pH 4–5 in der Schwefelwasserstoffgruppe ausgefällt, in Salpetersäure gelöst und mit Ammoniakwasser als Kupfertetramminkomplex nachgewiesen (Nachweise für Kationen, Nachweisreaktion).
Verwendung
Kupfer(II)-sulfid wird für fäulnishemmende Anstriche verwendet.
In den 1970er und 1980er Jahren wurde Kupfer(II)-sulfid als Kathodenmaterial in Lithium-Batterien für Herzschrittmacher eingesetzt.
Einzelnachweise
- ↑ a b c d e Eintrag zu Kupfer(II)-sulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ a b
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 982.



