Ölsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
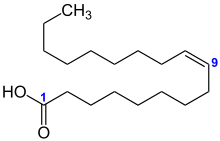
| |||||||||||||||||||
| Strukturformel mit der Nummerierung ausgewählter Kohlenstoffatome | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ölsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H34O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit fettartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 282,46 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,89 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
360 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (12 mg·l−1, 25 °C)[2], löslich in Methanol | ||||||||||||||||||
| Brechungsindex |
1,4582 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
noch nicht festgelegt[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Ölsäure, auch Oleinsäure, ist der wichtigste Vertreter der einfach ungesättigten Fettsäuren (18:1). Ihr systematischer Name lautet (Z)-9-Octadecensäure und sie ist aufgrund der Lage ihrer Doppelbindung eine Omega-9-Fettsäure. Ein natürlich vorkommendes Isomer der Ölsäure ist die Petroselinsäure, das trans-Isomer wird als Elaidinsäure bezeichnet. Die Salze und Ester der Ölsäure nennt man Oleate.

Vorkommen
Ölsäure kommt chemisch gebunden in Triglyceriden in fast allen natürlichen (pflanzlichen und tierischen) Ölen und Fetten vor. Einen besonders hohen Anteil an derartig veresterter Ölsäure besitzen z. B. Olivenöl (70–75 %), Erdnussöl (50–70 %)[3], Rapsöl (HEAR-Sorten 12–24 %, LEAR-Sorten 50–65 %[7]), Avocadoöl (44–76 %)[3], Gänsefett (41–72 %)[3], Palmöl (37–42 %)[3], Schweineschmalz (36–52 %)[3], Sesamöl (35–46 %)[3], Hammeltalg (31–56 %)[3], Rindertalg (26–45 %), Sonnenblumenöl (14–65 %)[8] und insbesondere sogenanntes High-Oleic-Sonnenblumenöl aus speziell gezüchteten Sorten mit 75–93 % Ölsäureanteil.
Entgegen weitverbreiteter Anschauung enthalten diese natürlichen Fette und Öle keine freie Ölsäure, sondern deren Glycerinester.
Gewinnung und Darstellung
Die Fettsäuren lassen sich durch alkalische Verseifung aus den entsprechenden Triacylglyceriden gewinnen, indem die entsprechenden Fette oder Öle mit Basen gekocht werden. Die Verseifung selbst liefert zunächst deren Salze. Die freien Fettsäuren werden durch Neutralisation mit (Mineral-)Säure erhalten. Da die natürlichen Fette und Öle stets viele unterschiedliche Fettsäuren enthalten, schließt sich in der Regel eine destillative Trennung des entstandenen Gemisches an.
Kommerziell wird Ölsäure über eine Hydrolyse und anschließende Kristallisation aus Talg gewonnen. Durch diesen Prozess können Konzentrationen von etwa 70 % gewonnen werden, die als Olein bezeichnet werden.[9] Neben Ölsäure können in diesem Gemisch Palmitoleinsäure, Linolsäure und weitere ungesättigte und gesättigte Fettsäuren enthalten sein.[10] Durch Hydrolysierung von sehr ölsäurereichen Pflanzenölen wie Olivenöl, Euphorbia lathyris oder High-Oleic-Sonnenblumen können Reinheiten von mehr als 90 % gewonnen werden.[9]
Eigenschaften
Physikalische Eigenschaften
Reine Ölsäure ist eine farblose, ölige und fast geruchlose Flüssigkeit. Die molare Masse beträgt 282,46 g·mol−1 und die Dichte 0,89 g·cm−3[3] Sie hat einen Schmelzpunkt von 17 °C[2] und einen Siedepunkt von 360 °C.[2] Die Fettsäure ist unlöslich in Wasser, jedoch löslich in Methanol. Der Flammpunkt liegt bei 189 °C, die Zündtemperatur bei 250 °C.[2]
Chemische Eigenschaften
Ölsäure ist im Vergleich zu den mehrfach ungesättigten Fettsäuren (z. B. Linolensäure) nur wenig oxidationsempfindlich. Sie oxidiert langsam an der Luft unter Gelbfärbung, die auf die Bildung von Zerfallsprodukten zurückzuführen ist. Hauptangriffspunkt der Oxidation ist die C-C-Doppelbindung. Sie wird dabei besonders von Licht, Wärme oder gelösten Metallionen gefördert und verläuft hauptsächlich über radikalische Reaktionsmechanismen. Wichtiger Zwischenschritt der Oxidation ist die Bildung von Hydroperoxiden (–OOH) beim Aufbrechen der C=C-Doppelbindung. Die funktionelle Gruppe (–OOH) bildet selbst ebenfalls Radikale und fördert so eine oxidative Kettenreaktion. Weiter können Hydroperoxide zu Ketonen zerfallen und, falls es auch zu einer Spaltung der einfachen C–C-Bindung kommt, auch zu Aldehyden oder Carbonsäuren.
Ölsäure und speziell ihre Salze sind amphiphil, das heißt, sie beinhalten sowohl einen polaren hydrophilen Teil (die Carboxygruppe) als auch einen unpolaren lipophilen Teil (die Kohlenwasserstoffkette).
Nomenklatur
Ölsäure wird nach IUPAC mit „(Z)-9-Octadecensäure“ bezeichnet; hierbei erhält das Kohlenstoffatom der Carboxygruppe die Lokantenziffer 1 (Strukturbild links blaue 1), die Doppelbindung ist an Position 9 (blaue 9) und das Molekül besitzt (Z)-Konfiguration (siehe cis-trans-Isomerie). Daneben werden für die Nahrung relevante ungesättigte Fettsäuren zusätzlich mit einem Lipidnamen versehen, hier 18:1 (ω−9); dieser leitet sich von der Anzahl der Kohlenstoffatome und der Doppelbindungen ab (18:1) und gibt zusätzlich die Position der Doppelbindung, gezählt vom ω-Ende des Moleküls aus, an. In diesem Fall erhält das der Carboxygruppe entgegengesetzte Kohlenstoffatom die Position 1 oder ω (grüne Beschriftung); die Position der Doppelbindung ist zufällig identisch mit der IUPAC-Bezeichnung (grüne 9).
Nachweis
Der Nachweis und die Gehaltsbestimmung von Ölsäure wie auch anderer Fettsäuren in Fetten wird in der Regel durch Gaschromatographie der Methylester durchgeführt; ergänzend kann eine Trennung der ungesättigten Isomere mit Silbernitrat-Dünnschichtchromatographie erfolgen.[11] Eine zweite, unspezifische Nachweismethode ist die Bromwasserprobe. Als Resultat hat man ein Verschwinden der Braunfärbung.
Verwendung
Ölsäure wird als Bestandteil von Mischungen mit anderen Fettsäuren in veränderlichen Anteilen vor allem zur Herstellung von Seifen und Metallseifen sowie für die Tensidproduktion verwendet.[9] Eine Verwendung als Schmälzmittel in der Textilindustrie ist belegt.[12]
Einzelnachweise
- ↑ Eintrag zu OLEIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d e f g h i j Eintrag zu Ölsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f g h i j Eintrag zu Ölsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Mai 2012.
- ↑ C. D. Cappa, E. R. Lovejoy, A. R. Ravishankara: Evaporation Rates and Vapor Pressures of the Even-Numbered C8–C18 Monocarboxylic Acids. In: J. Phys. Chem. A 112, 2008, S. 3959–3964, doi:10.1021/jp710586m.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-406.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 653–654, ISBN 3-342-00280-8.
- ↑ Eintrag zu Rapsöl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Mai 2012.
- ↑ Eintrag zu Sonnenblumenöl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Mai 2012.
- ↑ a b c Stichwort „Oleic Acid“ In: Hans Zoebelein (Hrsg.): Dictionary of Renewable Ressources. 2. Auflage, Wiley-VCH, Weinheim / New York 1996, ISBN 3-527-30114-3, S. 92.
- ↑ Stichwort „Olein“ In: Hans Zoebelein (Hrsg.): Dictionary of Renewable Ressources. 2. Auflage, Wiley-VCH, Weinheim / New York 1996, ISBN 3-527-30114-3; S. 92.
- ↑ B. Breuer, T. Stuhlfauth, H. P. Fock: Separation of Fatty Acids or Methyl Esters Including Positional and Geometric Isomers by Alumina Argentation Thin-Layer Chromatography. In: Journal of Chromatographic Science. 25, 1987, S. 302–306, doi:10.1093/chromsci/25.7.302.
- ↑ Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 1245.
Weblinks
- Eintrag zu Ölsäure. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
- Ölsäurekristalle, englisch
- 3D-Abbildung der kristallinen Ölsäure-Konformation
