2,2-Diethoxytetrahydrofuran
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 2,2-Diethoxytetrahydrofuran | ||||||||||||
| Andere Namen |
Diethoxyoxolan | ||||||||||||
| Summenformel | C8H16O3 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 160,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Siedepunkt | |||||||||||||
| Brechungsindex | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
2,2-Diethoxytetrahydrofuran ist ein cyclischer Orthoester, der mit Diolen zu bioabbaubaren Polyorthoestern umgesetzt werden kann.
Darstellung
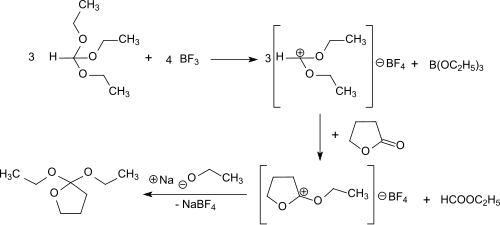
Die Synthese von 2,2-Diethoxytetrahydrofuran durch Reaktion von γ-Butyrolacton und dem Meerwein-Salz Triethyloxoniumtetrafluoroborat in Diethylether wurde zuerst von Hans Meerwein und Mitarbeitern beschrieben.[2] Das elektrophile Ethylkation lagert sich dabei stets an den Carbonylsauerstoff an und bildet den isolierbaren, aber außerordentlich hygroskopischen Feststoff (Fp. 42 °C) O-Ethyl-γ-butyrolactonium-tetrafluoroborat, der sich in Dichlormethan, Chloroform und 1,2-Dichlorethan löst, in Diethylether, Benzol und Tetrachlorkohlenstoff unlöslich ist. Das Oniumsalz addiert praktisch quantitativ ein Ethanolatanion aus Natriumethanolat in Ethanol glatt zum 2,2-Diethoxytetrahydrofuran.
Unter Vermeidung der Verwendung von Diethylether als Lösungsmittel und seiner Bildung als Nebenprodukt bei der Synthese, sowie der Isolierung schwer handhabbarer Zwischenprodukte kann 2,2-Diethoxytetrahydrofuran auch in einer Eintopfreaktion ohne Lösungsmittel mit den Reaktanden γ-Butyrolacton, Orthoameisensäuretriethylester und gasförmigem Bortrifluorid hergestellt werden.[4] Zunächst bildet sich aus dem Triethylorthoformiat und Bortrifluorid bei −30 °C Diethoxymethylium-tetrafluoroborat, das die Carbonylgruppe des γ-Butyrolactons electrophil angreift und zum O-Ethyl-γ-butyrolactoniumtetrafluoroborat umsetzt. Zugegebenes Natriumethanolat in Ethanol reagiert zum Endprodukt, das nach Destillation in 69%iger Gesamtausbeute erhalten wird.
Die Reaktion verläuft unter schonenden Bedingungen (<0 °C), und die praktisch quantitative Addition von Ethanolat an O-Ethyl-γ-butyrolactoniumtetrafluoroborat kann auch durch Basen wie Ammoniak und Triethylamin katalysiert werden.
Eigenschaften
2,2-Diethoxytetrahydrofuran ist eine wasserklare Flüssigkeit, die nach Angaben in der Originalliteratur[2] bei 60–61,5 °C unter 10 mm Hg Vakuum siedet.
Verwendung
Der cyclische Orthoester 2,2-Diethoxytetrahydrofuran ist ein reaktives bifunktionelles Monomer, das durch Umesterung mit α,ω-Diolen bioabbaubare Polyorthoester des Typs POE-I bildet.
Polyorthoester finden Verwendung als Einbettungsmedien für Pharmaka in Depotarzneiformen zur kontrollierten Wirkstofffreisetzung durch Oberflächenerosion unter physiologischen Bedingungen.[5]
Einzelnachweise
- ↑ a b c d Patent US4990631: Process for the preparation of 2,2-Dialkoxy cyclic ortho esters derived from lactones. Veröffentlicht am 5. Februar 1991, Anmelder: Alza Corp., Erfinder: K. Alster.
- ↑ a b c H. Meerwein, P. Borner, O. Fuchs, H.J. Sasse, H. Schrodt, J. Spille: Reaktionen mit Alkylkationen. In: Chem. Ber. Band 89, Nr. 9, 1956, S. 2060–2079, doi:10.1002/cber.19560890907.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2,2-Diethoxytetrahydrofuran im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 24. Oktober 2021.
- ↑ Patent US4990631: Reacting trialkyl orthoformate with boron trifluoride and lactone, then with alkoxide or alkanol and base. Veröffentlicht am 5. Februar 1991, Anmelder: Alza Corp., Erfinder: K. Alster.
- ↑ Jorge Heller: 6. Poly (Ortho Esters). In: A.J. Domb, J. Kost, D.M. Wiseman (Hrsg.): Handbook of Biodegradable Polymers. Harwood Academic Press, 1997, ISBN 90-5702-153-6, S. 99–118.