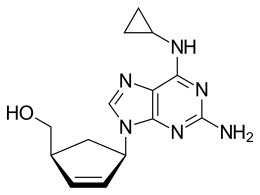
Abacavir
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| (1S,4R)-Isomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Abacavir | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse |
Virustatikum, nukleosidische Reverse-Transkriptase-Inhibitoren | ||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Abacavir ist ein Arzneistoff zur Behandlung von mit HIV-1 infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie. Er gehört als Nukleosidanalogon zur Gruppe der carbocyclischen, nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI). Das Suffix -cavir beschreibt ein carbocyclisches Nukleosid.
Eine Besonderheit ist, dass die Therapie mit Abacavir an einen vorherigen Gentest gebunden ist.[3] Bei diesem Test wird das Vorhandensein des Genmarkers HLA-B*57:01 überprüft. Bei Patienten mit diesem Genmarker tritt in bis zu 80 % der Fälle eine unter Umständen lebensbedrohliche Überempfindlichkeitsreaktion auf.
Pharmakologie
Pharmakodynamik
Abacavir wird zunächst in das Triphosphat umgewandelt. Zusätzlich wird der Basenanteil metabolisiert. Als biologisch aktives Stoffwechselprodukt entsteht Carbovirtriphosphat. Dieses hemmt die reverse Transkriptase. Es wirkt in vitro teilweise synergistisch mit Nukleosiden und HIV-Proteaseinhibitoren.
Pharmakokinetik
Die Bioverfügbarkeit beträgt über 70 %. Die Eliminationshalbwertzeit wird mit ca. 1,5 Stunden angegeben. Für das aktive Triphosphat wird die intrazelluläre Halbwertzeit mit 3 bis 4 Stunden angegeben. Die Einnahme erfolgt in zwei täglichen Einzeldosen zu 300 mg. Nahrungsmittel verzögern die Resorption und erniedrigen die maximale Plasmakonzentration. Da jedoch der AUC-Wert nicht beeinflusst und daher die Therapie nicht beeinträchtigt wird, ist die Einnahme unabhängig von den Mahlzeiten möglich.[3] Bei regelmäßiger Anwendung sind maximale Spiegel von (3,0 ± 0,9) mg/l angegeben, als AUC-Wert wurde (6,0 ± 1,7) mg/l × h berechnet. Die Konzentration im Liquor entspricht ca. einem Drittel der Plasmakonzentration. Abacavir wird überwiegend (ca. 85 %) metabolisiert und mit dem Urin ausgeschieden. Der Arzneistoff wird nicht durch das Cytochrom-P450-System verstoffwechselt. Es besteht kein entsprechendes Interaktionspotential. Primär wird Abacavir in der Leber über die Alkohol-Dehydrogenase biotransformiert.
Nebenwirkungen
Wichtigste Nebenwirkung ist eine Überempfindlichkeitsreaktion (ca. 5 %). Symptome: Fieber, Exanthem, Abgeschlagenheit und gastrointestinale Symptome. Die Beschwerden treten in der Regel zwischen der ersten und vierten Behandlungswoche auf. Nach Absetzen des Medikamentes sind die Beschwerden innerhalb von ein bis zwei Tagen rückläufig. Abacavir darf danach nicht noch einmal verabreicht werden. Eine schwere lebensbedrohliche Überempfindlichkeitsreaktion mit Blutdruckabfall trat gehäuft innerhalb von ein bis zwei Stunden auf. Selten wurden Laktatazidose und Hepatomegalie beobachtet.
Für das Auftreten der Überempfindlichkeitsreaktion besteht eine genetische Prädisposition: Bei Patienten mit dem Allel HLA-B*57:01 tritt die Hypersensitivitätsreaktion in bis zu 80 % der Fälle auf. Deshalb ist vor dem Beginn einer Therapie mit Abacavir ein genetischer Test auf das Vorhandensein des entsprechenden Gens angezeigt.[3] Unabhängig davon ist Abacavir bei den ersten Zeichen einer Überempfindlichkeitsreaktion abzusetzen.
Es scheint, dass bei Patienten mit hohem kardiovaskulärem Risiko ein erhöhtes Herzinfarkt-Risiko, vor allem bei einer neu begonnenen Abacavir-Therapie, besteht.
Plasmakonzentrationen können erhöht sein, wenn gleichzeitig Alkohol konsumiert wird. Wechselwirkungen mit Zidovudin oder Lamivudin sind gering. Interaktionen mit dem Cytochrom-P450-System sind unwahrscheinlich.
Resistenzen
Über die Mechanismen der Resistenzentwicklung sind Details bekannt. Veränderungen der Aminosäuren 65, 74, 115 und 184 der reversen Transkriptase sind mit einer Reduktion der Empfindlichkeit assoziiert. Auch ähnliche Nukleoside wie Zalcitabin und Didanosin sind gegen solche Stämme in der Regel weniger wirksam. Um der Resistenzbildung entgegenzuwirken ist die Kombination im Rahmen einer HAART zwingend erforderlich.
Stereoisomerie
Abacavir ist chiral und enthält in 1- und in 4-Position des Cyclopentenylrings zwei stereogene Zentren. Also existieren vier Stereoisomere: Die (1S,4S)-Form, die (1R,4R)-Form, die (1R,4S)-Form und die (1S,4R)-Form. Als Arzneistoff Abacavir wird ausschließlich das (1S,4R)-Diastereomer eingesetzt.[4]
Pharmazeutische Informationen
Arzneilich verwendet wird das wasserlösliche Abacavirhemisulfat (2 Abacavir·H2SO4). Es ist oral anwendbar. Bekannt sind auch das Succinat sowie das Mono- und das Dichlorid.
Geschichtliches
Das Patent für Abacavir wurde 1988 in den USA angemeldet. Als Vorteile gegenüber anderen Mitteln, die sich damals auf dem Markt befanden, zeigte sich die nur noch zweimal täglich notwendige Dosierung, die Unabhängigkeit der Einnahme von den Mahlzeiten und das geringe Interaktionspotential. In der Kombinationstherapie konnte es mit Zidovudin und Lamivudin kombiniert werden.[5][6] Nachdem es 1998 schon in den Vereinigten Staaten zugelassen worden war, wurde dem Hersteller Glaxo Wellcome am 8. Juli 1999 in der Europäischen Union die Zulassung für die antiretrovirale Kombinationstherapie von Erwachsenen mit HIV-Infektion erteilt. In Deutschland war es ab dem 15. Juli 1999 unter dem Handelsnamen Ziagen® verfügbar.[7] Die Kombinationstherapie mit Combivir® (Azidothymidin+Lamivudin) stellte damals das kompakteste Therapieregime dar.[8] Ein großes Problem war das oben beschriebene Hypersensitivitätssyndrom. Im Januar 2000 verschickte die Firma Glaxo-Wellcome GmbH & Co. einen Rote-Hand-Brief.[9] Am 15. November 2000 erteilte die FDA Glaxo Wellcome für Trizivir® (600 mg Abacavir+150 mg Lamivudin+300 mg Zidovudin), der ersten Dreierkombination in der antiretroviralen Therapie, die Zulassung.[10] Zwei Monate später im Januar 2001 folgte die europäische Zulassung. Jetzt für das im Dezember 2000 durch Fusion entstandene Unternehmen GlaxoSmithKline plc.. Durch Trizivir® wurde die Dosierung auf die zweimal tägliche Einnahme einer Tablette reduziert. Im Oktober 2001 wurde die Zulassung für eine pädiatrische Formulierung, einer Lösung mit Bananen-Erdbeergeschmack, für Kinder von 3 Monaten bis 18 Jahren erteilt. 2002 hatte man dann die einmal tägliche Applikation für Abacavir freigegeben. Ein weiterer Rote-Hand-Brief im Juli 2002 wies auf eine hohe Rate des Nicht-Ansprechens der Therapie bei der Dreierkombination von Abacavir mit Tenofovir und Lamivudin hin. In diesem Jahr wurde entdeckt, dass das Auftreten der Hypersensitivitätsreaktion von einem bestimmten HLA-Typ abhängig ist. Bei Vorliegen dieses Typs ist das Risiko für das Auftreten der Hypersensitivitätsreaktion um den Faktor 100 erhöht. In einem Rote-Hand-Brief im November 2008 wies die Firma GlaxoSmithKline auf die Notwendigkeit der Testung des HLA-Typs vor Therapiebeginn hin.
Handelsnamen
GlaxoSmithKline: Ziagen (D, A, CH); Generika
- mit Lamivudin: Kivexa (D, A, CH); Generika
- mit Lamivudin und Dolutegravir: Triumeq (D, A, CH)
- mit Lamivudin und Zidovudin: Trizivir (D, A, CH)
Weblinks
- Produktinformationen zu Ziagen, Kivexa und Trizivir auf der Website der europäischen Arzneimittelagentur.
- Antiretrovirale und wichtige Medikamente in HIV 2012. Das Buch zu HIV und AIDS.
- Substanzklassen, Medikamentenübersicht in HIV 2012. Das Buch zu HIV und AIDS.
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1, ISBN 978-0-911910-00-1.
- ↑ a b Datenblatt Abacavir sulfate bei Sigma-Aldrich, abgerufen am 30. Mai 2022 (PDF).
- ↑ a b c Fachinformation Ziagen 300 mg Filmtabletten. Stand Juli 2016.
- ↑ ROTE LISTE 2017, Verlag Rote Liste Service GmbH, Frankfurt am Main, S. 157, ISBN 978-3-946057-10-9.
- ↑ Christiane Berg: HIV-Forschung: Entwicklungen und Perspektiven. In: Pharmazeutische Zeitung. GOVI-Verlag, 25. Mai 1998.
- ↑ Daniel Rücker: Viel hilft viel - zumindest als Ultima ratio. In: Pharmazeutische Zeitung. GOVI-Verlag, 21. September 1998.
- ↑ Abacavir zugelassen. In: Pharmazeutische Zeitung. GOVI-Verlag, 19. Juli 1999 (pharmazeutische-zeitung.de).
- ↑ Ulrich Brunner, Eschborn, Brigitte M. Gensthaler: Neu auf dem Markt. In: Pharmazeutische Zeitung. 2. August 1999 (pharmazeutische-zeitung.de).
- ↑ Meldungen der Arzneimittelkommission der Deutschen Apotheker-Wichtige Sicherheitsinformation zur Hypersensitivitätsreaktion, Respiratorischen Symptomen und Ziagen (Abacavirhemisulfat). In: Pharmazeutische Zeitung. Band 2000, Nr. 4. GOVI-Verlag, 25. Januar 2000.
- ↑ Drei in einer Tablette. In: Pharmazeutische Zeitung. GOVI-Verlag, 27. November 2000 (pharmazeutische-zeitung.de).