Ammoniumiodid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
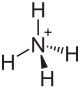 Iodidion Iodidion
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumiodid | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | NH4I | ||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 144,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
2,51 g·cm−3 (20 °C)[2] | ||||||||||||
| Schmelzpunkt |
551 °C (sublimiert)[3] | ||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1770 g·l−1 bei 25 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Ammoniumiodid ist das Ammoniumsalz des Iodwasserstoffs.
Eigenschaften
Ammoniumiodid bildet weiße, in Wasser und Ethanol leicht lösliche, kubische Kristalle. Es ist leicht zersetzbar und verfärbt infolge Oxidation des Iodid-Ions zu Iod I2 an der Luft gelb bis braun.[4] Die Verbindung kommt in drei Kristallstrukturen vor, wobei die Niedertemperaturform eine tetragonale Kristallstruktur mit der Raumgruppe P4/nmm (Raumgruppen-Nr. 129) besitzt.[5]
Synthese
Die Herstellung von Ammoniumiodid kann durch die Reaktion von Iod oder Iodwasserstoff mit Ammoniak oder Ammoniumcarbonat erfolgen:
- Fehler beim Parsen (Konvertierungsfehler. Der Server („https://wikimedia.org/api/rest_“) hat berichtet: „Cannot get mml. Server problem.“): {\displaystyle \mathrm {3\ I_{2}+8\ NH_{3}\longrightarrow 6\ NH_{4}I+N_{2}} }
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{NH_3 + HI \longrightarrow NH_4I}}
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{(NH_4)_2CO_3\cdot H_2O + 2\ HI \longrightarrow 2\ NH_4I + 2 \ H_2O + CO_2}}
Bei der Reaktion zwischen Iod I2 mit Ammoniakwasser ist jedoch Vorsicht geboten, da sehr leicht Iodstickstoff gebildet wird.
Im Labor erhält man Ammoniumiodidlösung ähnlich aus 10 % Ammoniakwasser, Iod und Wasserstoffperoxid:[6]
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{I_2 + 2\ NH_3 + H_2O_2 \longrightarrow 2\ NH_4I + O_2}}
Verwendung
Verwendung findet Ammoniumiodid in der phototechnischen Industrie und in der Medizin.
Einzelnachweise
- ↑ Eintrag zu AMMONIUM IODIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- ↑ a b c d Eintrag zu Ammoniumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b Datenblatt Ammonium iodide, 98+% bei AlfaAesar, abgerufen am 1. Februar 2019 (PDF) (JavaScript erforderlich).
- ↑ Ammoniumjodid – Artikel in Meyers Konversationslexikon, Verlag des Bibliographischen Instituts, Leipzig und Wien, Vierte Auflage, 1885–1892
- ↑ High Pressure Phase Transformations: A Handbook. CRC Press, 1992, ISBN 978-2-88124-759-0, S. 445 (books.google.de).
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 289–90.