Berylliumcarbonat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
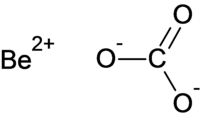
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Berylliumcarbonat | ||||||||||||
| Summenformel | BeCO3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 69,02 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
100 °C (Zersetzung)[2] | ||||||||||||
| Löslichkeit |
schwer löslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Berylliumcarbonat ist eine anorganische chemische Verbindung des Berylliums aus der Gruppe der Carbonate.
Vorkommen
Berylliumcarbonat kommt natürlich in Form des Minerals Niveolanit in Form der Mischverbindung NaBe(CO3)(OH)·2H2O vor.[2]
Gewinnung und Darstellung
Berylliumcarbonat-tetrahydrat kann durch Reaktion von Kohlendioxid mit einer wässrigen Lösung von Berylliumhydroxid gewonnen werden. Wenn Natriumcarbonat zu einer Berylliumsalzlösung gegeben wird und diese mit Kohlendioxid zur Reaktion gebracht wird, bildet sich Berylliumoxidcarbonat, das eine Mischung von Berylliumcarbonat und Berylliumhydroxid ist.[5]
Das Anhydrat kann durch mehrstündiges Glühen von Berylliumoxid im Kohlendioxid-Strom bei 1000 °C gewonnen werden.[2]
Basisches Berylliumcarbonat Be2CO3(OH)2 bildet sich bei Reaktion von Berylliumsulfat mit Ammoniumcarbonat und enthält sowohl Carbonat- als auch Hydroxid-Ionen.[2]
Eigenschaften
Berylliumcarbonat ist ein Feststoff, der schwer löslich in Wasser ist. Es gibt leicht Kohlendioxid ab und ist nur unter einer CO2-Atmosphäre haltbar.[1]
Lösliche Komplexe der Verbindung können durch Auflösung von Berylliumhydroxid in Ammoniumcarbonatlösungen erhalten werden.[6]
Verwendung
Berylliumcarbonat wird hauptsächlich als Zwischenprodukt bei der Herstellung von Beryllium aus Berylliumerzen verwendet.[2]
Einzelnachweise
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1113.
- ↑ a b c d e f Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 359 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Berylliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. August 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Berylliumverbindungen, ausgenommen Beryllium-Tonerdesilikate, und ausgenommen die namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. August 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Kenneth A. Walsh: Beryllium Chemistry and Processing. ASM International, 2009, ISBN 0-87170-721-7, S. 118 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gmelins Handbuch der Anorganischen Chemie. BERYLLIUM, System Nummer 26, Achte Auflage. Verlag Chemie, Berlin 1930, Seite 178–179





