Blei(IV)-fluorid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
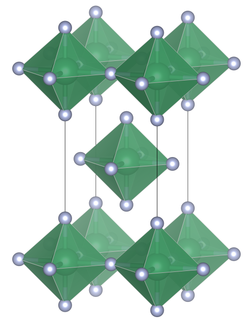
| |||||||||||||
| _ Pb4+ _ F− | |||||||||||||
| Kristallsystem |
tetragonal | ||||||||||||
| Raumgruppe |
I4/mmm (Nr. 139) | ||||||||||||
| Gitterparameter |
a 425,36 pm,c 806,4 pm, Z = 2 | ||||||||||||
| Koordinationszahlen |
[6]Pb | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Blei(IV)-fluorid | ||||||||||||
| Andere Namen |
Bleitetrafluorid | ||||||||||||
| Verhältnisformel | PbF4 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 283,18 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
6,7 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Blei(IV)-fluorid ist eine anorganische chemische Verbindung des Bleis aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Blei(IV)-fluorid kann durch Reaktion von Blei(II)-fluorid oder Blei mit Fluor gewonnen werden.[2]
Eigenschaften
Blei(IV)-fluorid ist ein weißer, kristalliner Feststoff, der sehr empfindlich gegen Feuchtigkeit ist. Er färbt sich an feuchter Luft durch Bildung von Bleidioxid sofort braun.[2]
Diese Reaktion passiert auch in verdünnter Flusssäure, in konzentrierter Flusssäure (oder reinem Fluorwasserstoff) entsteht Bleifluoridsäure ("fluoroplumbic acid").
Auch die Salze dieser Säure sind darstellbar.
Blei(IV)-fluorid besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I4/mmm (Raumgruppen-Nr. 139) [3] und den Gitterkonstanten a 425,36 pm,c 806,4 pm, sowie Z = 2. Die Verbindung besteht wie Zinn(IV)-fluorid aus PbF6-Oktaedern die über gemeinsame äquatoriale Brücken mit jeweils vier PbF6-Oktaedern zu planaren Schichten verknüpft sind.[4][5]
Einzelnachweise
- ↑ a b c d Datenblatt Lead(IV) fluoride, 99% bei AlfaAesar, abgerufen am 31. Oktober 2021 (PDF) (JavaScript erforderlich).
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 233.
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 660 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 970.
- ↑ M. Bork, R. Hoppe: Zum Aufbau von PbF4 mit Strukturverfeinerung an SnF4. In: Zeitschrift für anorganische und allgemeine Chemie. 622, 1996, S. 1557–1563, doi:10.1002/zaac.19966220919.







