Caesiumwolframat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Cs+ _ W6+ _ O2− | |||||||||||||
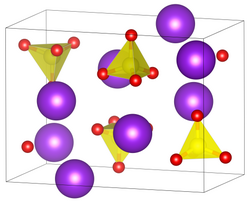
| Kristallsystem |
orthorhombisch | ||||||||||||
| Raumgruppe |
Pmcn (Nr. 62, Stellung 5) | ||||||||||||
| Gitterparameter |
| ||||||||||||
| Allgemeines | |||||||||||||
| Name | Caesiumwolframat | ||||||||||||
| Andere Namen |
Caesiumwolframoxid | ||||||||||||
| Summenformel | Cs2WO4 | ||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 513,66 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Caesiumwolframat ist eine anorganische chemische Verbindung des Caesiums aus der Gruppe der Wolframate.
Gewinnung und Darstellung
Beispiele möglicher Reaktionen sind:
- aus Wolfram(VI)-oxid und Caesiumhydroxid (analog der Darstellung von Natriumwolframat):
- aus Caesiumchlorid und Silberwolframat:[3]
Eigenschaften
Caesiumwolframat ist ein weißer geruchloser Feststoff, der löslich in Wasser ist.[2] Bei Raumtemperatur liegt die Verbindung in einem orthorhombischen Kristallsystem in der Raumgruppe Pmcn (Raumgruppen-Nr. 62, Stellung 5) isotyp zu Caesiummolybdat und β-Kaliumsulfat vor.[1] Bei 536 °C erfolgt eine Phasenumwandlung von einer orthorhombischen zu einer hexagonalen Kristallstruktur.[3]
Verwendung
Caesiumwolframat wird zur Herstellung von transparenten Isolationsbeschichtungen mit guten Eigenschaften für Infrarotstrahlung verwendet.[2]
Einzelnachweise
- ↑ a b F. X. N. M. Kools, A. S. Koster, G. D. Rieck: The Structures of Potassium, Rubidium and Caesium Molybdate and Tungstate. In: Acta Cryst. B26, 1970, S. 19741–1977, doi:10.1107/S0567740870005277.
- ↑ a b c d e f g Datenblatt Caesiumwolframat bei AlfaAesar, abgerufen am 12. Juni 2016 (PDF) (JavaScript erforderlich).
- ↑ a b Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3097 (eingeschränkte Vorschau in der Google-Buchsuche).

