Cer(III)-sulfat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
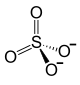
| |||||||
| Allgemeines | |||||||
| Name | Cer(III)-sulfat | ||||||
| Andere Namen |
| ||||||
| Summenformel | Ce2(SO4)3 | ||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 568,42 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Dichte | |||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
löslich in Wasser[3] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Cer(III)-sulfat ist eine anorganische chemische Verbindung des Cers aus der Gruppe der Sulfate.
Gewinnung und Darstellung
Cer(III)-sulfat kann durch Reaktion von Cer(IV)-sulfat mit Oxalsäure, Hydrazin oder Natriumthiosulfat gewonnen werden.[4]
Es kann auch durch Reaktion von Cer(IV)-oxid mit Schwefeldioxid dargestellt werden.[5]
Eigenschaften
Cer(III)-sulfat (wasserfrei) ist ein hygroskopischer weißer Feststoff,[1] der sich bei über 600 °C zu zersetzen beginnt. Er besitzt eine monokline Kristallstruktur. Sein Tetrahydrat ist ein weißer Feststoff, der ab 220 °C sein Kristallwasser abgibt. Er besitzt (wie das weiße Octahydrat) eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[6][2][7] Das Nonahydrat hat eine hexagonale Kristallstruktur mit der Raumgruppe P63/m (Raumgruppen-Nr. 176).[2] Von der Verbindung sind Hydrate mit 12, 9, 8, 5, 4 und 2 Teilen Kristallwasser bekannt.[8] Die Verbindung ist eine der wenigen Verbindungen deren Löslichkeit in Wasser mit der Temperatur abnimmt.[9] So beträgt die Löslichkeit des Anhydrates in Wasser bei 0 °C 101 g/l, bei 100 °C nur 2,5 g/l, die des Octahydrates bei 94,3 g/l bei 20 °C, 57 g/l bei 40 °C und 40,4 g/l bei 60 °C.[3]
Einzelnachweise
- ↑ a b c d e Datenblatt Cerium(III) sulfate, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 29. Oktober 2016 (PDF).
- ↑ a b c d e f g R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 374 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Singh: Chemistry Of Lanthanides And Actinides. Discovery Publishing House, 2007, ISBN 978-81-8356-241-6, S. 262 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gunther Kolb: Fuel Processing For Fuel Cells. John Wiley & Sons, 2008, ISBN 3-527-31581-0, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 2824 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Barbara M. Casari, Vratislav Langer: New Structure Type among Octahydrated Rare-Earth Sulfates, β-Ce2(SO4)3-8H2O, and a new Ce2(SO4)3-4H2O Polymorph. In: Zeitschrift für anorganische und allgemeine Chemie. 633, 2007, S. 1074, doi:10.1002/zaac.200700003.
- ↑ T. Mioduski: Identification of Saturating Solid Phases in the System Ce2(SO4)3-H2O from the Solubility Data. In: Journal of Thermal Analysis and Calorimetry. 55, S. 751, doi:10.1023/A:1010161212184.
- ↑ Daniel L. Reger, Scott R. Goode, David W. Ball: Chemistry: Principles and Practice. Cengage Learning, 2009, ISBN 978-0-534-42012-3, S. 482 (eingeschränkte Vorschau in der Google-Buchsuche).

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} \mathrm {\ {\Biggl [}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bafeab07e1d5bb8bb77e0767e55563945c55cd72)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0)




