Cobaltmolybdat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
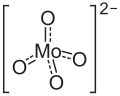
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cobaltmolybdat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CoMoO4 | ||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 218,87 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
4,69 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Cobaltmolybdat ist eine anorganische chemische Verbindung des Cobalts aus der Gruppe der Molybdate.
Vorkommen
Cobaltmolybdat kommt natürlich in Form des Minerals Paterait vor.[4]
Gewinnung und Darstellung
Cobaltmolybdat kann durch Reaktion von Cobalt(II)-nitrat und Ammoniumorthomolybdat gewonnen werden.[5][6]
Eigenschaften
Cobaltmolybdat ist ein violetter[7] geruchloser Feststoff, der wenig löslich in Wasser ist.[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12).[2] Bei hohen Drücken wandelt er sich in eine andere Kristallstruktur (β-Form) um. Diese hat eine Kristallstruktur mit der Raumgruppe P2/c (Raumgruppen-Nr. 13).[8] Er kommt auch in einer Hydratform vor die eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2) hat.[9] Die Niedertemperaturform hat eine grün-schwarze Farbe, während die Hochtemperaturform violett ist. Die Phasenumwandlung findet bei etwa 430 °C statt.[7]
Verwendung
Cobaltmolybdat ist ein sehr wichtiger Bestandteil von industriellen Katalysatoren und wird in der Gas- oder Flüssigkeits-Hydrodesulfurierung zum Beispiel von Benzin verwendet.[1]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Cobalt(II) molybdenum oxide, 99.9% (metals basis), Ni 0.5% max bei AlfaAesar, abgerufen am 2. November 2021 (PDF) (JavaScript erforderlich).
- ↑ a b G. W. Smith, J. A. Ibers: The crystal structure of cobalt molybdate CoMoO4. In: Acta Crystallographica. 19, S. 269, doi:10.1107/S0365110X65003201.
- ↑ Richard J. Lewis, Sr.: Hazardous Chemicals Desk Reference. John Wiley & Sons, 2008, ISBN 0-470-33445-2, S. 379 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. W. SMITH: Crystal Structure of Orthorhombic Cobalt Molybdate. In: Nature. 188, 1960, S. 306, doi:10.1038/188306b0.
- ↑ iarc.fr: Cobalt and Cobalt compounds, abgerufen am 10. Juli 2016
- ↑ V. Umapathy, P. Neeraja: Sol–Gel Synthesis and Characterizations of CoMoO4 Nanoparticles: An Efficient Photocatalytic Degradation of 4-Chlorophenol. In: Journal of Nanoscience and Nanotechnology. 16, 2016, S. 2960, doi:10.1166/jnn.2016.10761.
- ↑ a b E.R. Braithwaite, J. Haber: Molybdenum An Outline of its Chemistry and Uses. Elsevier, 2013, ISBN 978-1-4832-9089-8, S. 527 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Carine Livage, Amélie Hynaux, Jérôme Marrot, Marc Nogues, Gérard Férey: Solution process for the synthesis of the “high-pressure” phase CoMoO4 and X-ray single crystal resolution. In: Journal of Materials Chemistry. 12, S. 1423, doi:10.1039/B110760G.
- ↑ Kazuo Eda, Yuichi Uno, Noriko Nagai, Noriyuki Sotani, M. Stanley Whittingham: Crystal structure of cobalt molybdate hydrate CoMoO4-nH2O. In: Journal of Solid State Chemistry. 178, 2005, S. 2791, doi:10.1016/j.jssc.2005.06.014.



