Kupfer(II)-oxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
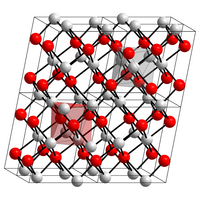
| |||||||||||||||||||
| _ Cu2+ _ O2− | |||||||||||||||||||
| Kristallsystem |
monoklin | ||||||||||||||||||
| Raumgruppe |
C2/c (Nr. 15) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(II)-oxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | CuO | ||||||||||||||||||
| Kurzbeschreibung |
schwarzer, amorpher oder kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 79,545 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
6,48 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
1326 °C[1] | ||||||||||||||||||
| Siedepunkt |
thermische Zersetzung: 1026 °C[1] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, löslich in verdünnten Säuren, löslich in Ammoniumhydroxid[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,1 mg·m−3 (gemessen als einatembarer Aerosolanteil)[1] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Kupfer(II)-oxid (früher Kupferasche, Kupferrost, gebranntes Kupfer und Kupferhammerschlag oder Kupferschlag[4][5] sowie Kupferkalk und lateinisch aes ustum[6] genannt) ist eine chemische Verbindung, die Kupfer und Sauerstoff enthält. In diesem Oxid mit der Summenformel CuO ist Kupfer zweiwertig. Kupfer(II)-oxid ist ein schwarzer, amorpher oder kristalliner Feststoff.
Vorkommen
In der Natur kommt Kupfer(II)-oxid als das Mineral Tenorit vor.[7] Tenorit entsteht bei der Verwitterung von Kupfersulfiden und findet sich daher üblicherweise in oxidierten Teilen von Kupfervorkommen. Das Mineral ist nach dem italienischen Botaniker Michele Tenore benannt.
Gewinnung und Darstellung
Kupfer(II)-oxid kann durch thermische Zersetzung (Pyrolyse) von Kupfer(II)-nitrat oder basischem Kupfercarbonat dargestellt werden.
Kupfer(II)-oxid kann auch durch Erwärmen von (frisch gefälltem) Kupfer(II)-hydroxid hergestellt werden. Das Kupfer(II)-hydroxid wird durch Zugabe von Alkalihydroxiden zu einer Cu(II)-Salzlösung ausgefällt.
Kupfer(II)-oxid bildet sich zusammen mit Kupfer(I)-oxid beim Erhitzen von metallischem Kupfer auf Rotglut an Luft.
Früher wurde Aes ustum[8] gewonnen durch schichtweises Einbringung von Kupferblechen mit Kochsalz in einen verschließbaren Schmelztiegel und zwölf Stunden weißgeglüht. Der Glührückstand wurde pulverisiert und mit Wasser ausgelaugt.[9]
Eigenschaften
Kupfer(II)-oxid ist unlöslich in Wasser und Alkoholen. Dagegen ist es in verdünnten Säuren löslich. Durch Eindampfen können die entsprechenden Kupfer(II)-salze erhalten werden. Kupfer(II)-oxid ist unter Komplexbildung in Ammoniakwasser löslich.
Kupfer(II)-oxid adsorbiert leicht Sauerstoff, Stickstoff, Kohlendioxid und andere Gase.
Beim Erhitzen über etwa 800 °C wird Kupfer(II)-oxid unter Sauerstoffabgabe zu Kupfer(I)-oxid reduziert.
Werden metallisches Kupfer und Kupfer(II)-oxid zusammen erhitzt entsteht ebenfalls Kupfer(I)-oxid.
Kupfer(II)-oxid wird bei erhöhter Temperatur durch verschiedene Reduktionsmittel (beispielsweise Kohlenstoff, Kohlenmonoxid, Wasserstoff) zu metallischem Kupfer reduziert.
Beim Erhitzen von Kupfer(II)-oxid mit Fluorwasserstoff auf 400 °C wird Kupfer(II)-fluorid gebildet.
Es besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15) (a = 4,683 Å, b = 3,423 Å, c = 5,129 Å, β = 95,54°). Seine Bildungsenthalpie beträgt −155,8 kJ/mol.[10]
Verwendung
Kupfer(II)-oxid wird als Pigment zum Färben von Glas, Keramik, Porzellan und künstlichen Edelsteinen verwendet. Daneben findet es Anwendung als Kathodenmaterial in Batterien, als Katalysator, zur Entschwefelung von Erdöl und für fäulnishemmende Anstriche. Kupfer(II)-oxid wird auch als Ausgangsstoff für die Herstellung von verschiedenen Kupferverbindungen genutzt. Seit der Entdeckung der Supraleitung von Verbindungen von La2CuO4 (dotiert mit Strontium) und der nachfolgenden Entdeckung von weiteren über hundert ähnlichen Verbindungen, die zum größten Teil nicht ohne Kupfer und Sauerstoff auskommen, wird Kupfer(II)-oxid auch für die keramischen Supraleiter verwendet, die als zukunftsträchtige Materialien gelten.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Kupfer(II)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Kupferoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- ↑ Eintrag zu copper(II) oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 17. Juni 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Emil Ernst Ploß: Ein Buch von alten Farben. Technologie der Textifarben im Mittelalter mit einem Ausblick auf die festen Farben. 6. Aufl. München 1989, ISBN 978-3-89164-060-9.
- ↑ Wolfgang Schneider: Pharmazeutische Chemikalien und Mineralien. Ergänzungen (zu Band III des Lexikons zur Arzneimittelgeschichte). Frankfurt am Main 1975, S. 85.
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 133 (Aes).
- ↑ Mindat: Tenorite (engl.)
- ↑ Vgl. auch Ute Obhof: Rezeptionszeugnisse des „Gart der Gesundheit“ von Johann Wonnecke in der Martinus-Bibliothek in Mainz – ein wegweisender Druck von Peter Schöffer. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 36/37, 2017/2018, S. 25–38, hier: S. 32 (Es ustum „gebrant ercz“).
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 133.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 979.










