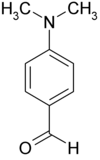
Dimethylaminobenzaldehyd
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dimethylaminobenzaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H11NO | |||||||||||||||
| Kurzbeschreibung |
hellgelber bis grüner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 149,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Dimethylaminobenzaldehyd, oder genauer 4-(N,N-Dimethylamino)benzaldehyd, ist ein Benzaldehyd-Derivat, das in para-Position einen N,N-Dimethylaminorest trägt.
Verwendung
Eine Lösung aus 2 % Dimethylaminobenzaldehyd in 20 %iger Salzsäure wird als Ehrlich-Reagenz oder Ehrlich-Pröscher-Reagenz bezeichnet. Es dient zum Nachweis von primären Aminogruppen, Pyrrol- und Indol-Derivaten. Das Ehrlich-Reagenz wurde nach dem Entdecker Paul Ehrlich benannt.
In der Medizin wird das Ehrlich-Reagenz zum Nachweis von Porphobilinogen und Urobilinogen im Urin genutzt (Watson-Schwartz-Test und Hoesch-Test).
In der Pharmazie wird das Ehrlich-Reagenz zum Nachweis von Pyrrol- und Indol-Derivaten (z. B. Mutterkornalkaloide) verwendet (Van-Urk-Reaktion).[4]
In der Mikrobiologie wird Dimethylaminobenzaldehyd (Kovacs-Reagenz) zum Nachweis von Indol verwendet (Indol-Test). Da es in dieser Anwendung auch zum Nachweis von LSD geeignet ist, hat es in der Drogenszene eine gewisse Bekanntheit erlangt.
Darstellung
Dimethylaminobenzaldehyd kann durch Umsetzung von N,N-Dimethylanilin mit einem Formamid-Derivat durch eine Vilsmeier-Haack-Reaktion synthetisiert werden.
Einzelnachweise
- ↑ a b c d Datenblatt Dimethylaminobenzaldehyd bei Acros, abgerufen am 19. Februar 2010.
- ↑ a b Eintrag zu p-Dimethylaminobenzaldehyde in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ Datenblatt 4-(Dimethylamino)benzaldehyde bei Sigma-Aldrich, abgerufen am 5. Mai 2011 (PDF).
- ↑ S. Ebel und H. J. Roth (Hrsg.): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 213, ISBN 3-13-672201-9.
Literatur
- Pröscher, F. (1900): Zur Kenntniss der Ehrlich’schen Dimethylamidobenzaldehyd-Reaktion. In: Hoppe-Seyler’s Zeitschrift für physiologische Chemie. Bd. 31, S. 520–526.