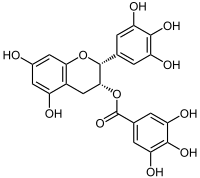
Epigallocatechingallat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Epigallocatechingallat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C22H18O11 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 458,36 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Epigallocatechingallat, engl. Epigallocatechin gallate, (EGCG), ist ein Carbonsäureester der Gallussäure mit dem Alkohol und Catechin Epigallocatechin. Das Antioxidans stellt die Mehrheit aller Catechine des grünen Tees dar.[5] Im schwarzen Tee ist der Anteil an Catechinen deutlich geringer, da aufgrund der Fermentation die Catechine zu oligomeren Theaflavinen reagieren. Der Verbindung wird eine positive Wirkung auf die Gesundheit zugesprochen.
Vorkommen
Tee
In relativ hohen Mengen liegt es in den koffeinhaltigen Teesorten vor, davon am meisten in unfermentiertem Tee, siehe Grüntee und Weißtee.[6][7]
Andere Quellen
Spuren finden sich auch in der Schale von Äpfeln (insbesondere die polyphenolhaltigen alten Apfelsorten[8]), in Pflaumen, Zwiebeln, Haselnüssen, Pekannüssen, Pistazien, Birnen, Kiwis, Himbeeren, Erdbeeren. Vergleichsweise deutlich mehr findet sich im Fruchtpulver sowie dem Mehl aus den Samen des Johannisbrotbaums.[7]
Medizinische Aspekte
Angiogenese
Verschiedene Experimente zeigen, dass EGCG eine antiangiogenetische Wirkung (Wachstumshemmung von Blutgefäßen) besitzt. Nach Xenotransplantation von krankhaftem menschlichem endometrialem Gewebe in Mäuse konnte diese Wirkung gezeigt werden. Der humane Ursprung des Gewebes lässt eine Wirkung bei der menschlichen Endometriose vermuten.[9] Weiterhin wurden ähnliche Wirkungen durch In-vitro- und In-vivo-Experimente mit Hamstern nachgewiesen.[10]
Eine antiangiogenetische Wirkung von EGCG könnte auch genutzt werden, um das Wachstum von Tumorgewebe abzuschwächen. Tumoren benötigen ebenfalls Blutgefäße, um ausreichend mit Sauerstoff und Nährstoffen versorgt zu werden. EGCG hemmt die Aktivität von Wachstumsfaktoren, die beim Mechanismus der Angiogenese erforderlich sind, wie z. B. das pro-angiogenetische Interleukin-8.[11][9] Die Bindung des Peptidhormons VEGF an seinen Rezeptor wird durch EGCG inhibiert.[12] In einem Mausmodell des Magenkarzinoms wurde eine Hemmung der VEGF-abhängigen Angiogenese durch EGCG gezeigt.[13]
Auch über eine positive Beeinflussung der Elastizität der Blutgefäße (Endothelfunktion), die eine zentrale Rolle bei der Entstehung der Arteriosklerose (Atherogenese) spielt, wurde berichtet.[14][15]
Zellzyklus
Ebenfalls unterstützt EGCG das Tumorsuppressorprotein P27, das den Zellzyklus kontrolliert und eine außer Kontrolle geratene Zellteilung verhindert. Es hemmt dabei Wachstumsfaktoren, indem es an sie bindet.[16]
Neurodegenerative Erkrankungen
Neurodegenerative Erkrankungen wie Alzheimer und Parkinson werden durch die Bildung von Amyloidfibrillen verursacht. EGCG verhindert deren Bildung durch Bindung an die nativen, noch ungefalteten Polypeptidketten. Dadurch werden statt der toxischen faserförmigen Amyloidfibrillen harmlose sphärische Oligomere gebildet.[17] Studien weisen darauf hin, dass EGCG Plaques auflösen kann.[17] Im Modellorganismus Farbmaus konnte gezeigt werden, dass nach sechsmonatiger EGCG-Behandlung die Plaque-Belastung im Kortex, Hippocampus und im entorhinalen Kortex um jeweils 54, 43 und 58 % reduziert wurde.[18]
Immunologie
Eine japanische Forschungsgruppe zeigte in Labortests, dass EGCG die Invasion von HI-Viren in T-Lymphozyten verhindern kann, da es wie die HI-Viren eine Affinität zu den CD4-Molekülen an der Zelloberfläche der T-Lymphozyten aufweist. Durch die Besetzung der CD4-Rezeptoren durch das EGCG kann das Virus nicht mehr an die T-Lymphozyten andocken und diese somit nicht mehr infizieren.[19]
Auch gegen das Influenza-A-Virus zeigte sich EGCG effektiv. Sowohl bei Experimenten mit Zellkulturen als auch im Tierversuch vermochte es die Vermehrung des Virus signifikant abzusenken und bei infizierten Mäusen die mittlere Überlebenszeit deutlich zu erhöhen.[20]
Außerdem weisen Studien in der Multiple-Sklerose-Forschung darauf hin, dass EGCG sowohl Nervenzellen im Zentralnervensystem vor Schädigungen schützen, als auch fehlgeleitete T-Lymphozyten, welche für die Krankheit verantwortlich gemacht werden, regulieren kann. So war der Verlauf der experimentellen autoimmunen Enzephalomyelitis – dem Tiermodell der Multiplen Sklerose – bei Gabe von EGCG signifikant milder als bei Tieren, die kein EGCG erhielten.[21][22]
EGCG neutralisiert ebenfalls TNF-α und vermindert so die Produktion von Interleukin-6 und -8, was die teils immunsuppressive Wirkung erklärt.[11]
Stoffwechsel
Catechine gelten allgemein als Radikalfänger von reaktiven Sauerstoff- (ROS) und Stickstoffspezies (RNS). Diese beiden Typen von Verbindungen sind für oxidative Schäden an der DNA verantwortlich.[23]
Bindung am Cannabinoid-Rezeptor 1
EGCG bindet sich an den Cannabinoid-Rezeptor 1 mit einer Bindungsaffinität von Ki = 33,6 μM.[24]
Potente Hemmung der 11β-Hydroxysteroid-Dehydrogenase 1
Eine Studie von 2014 fand, dass Epigallocatechingallat des grünen Tees die 11β-Hydroxysteroid-Dehydrogenase 1 potent hemmt, dadurch weniger Cortisol verfügbar ist und dadurch ggf. Teile der gesundheitsfördernden Eigenschaften des grünen Tees erklärt werden könnten, da Cortisol eine entscheidende Rolle u. a. in der psychophysiologischen Stressreaktion spielt.[25]
Hitzestabilität und Epimerisierung
In einer Umgebung mit hohen Temperaturen ist eine Epimerisierung von (−)-Gallocatechingallat zu (−)-EGCG sowie die Zersetzung möglich. Die Exposition in kochendem Wasser für 30 Minuten führt zu einer 12,4%igen Reduktion der EGCG-Gesamtmenge. Bei der kurzen Aufbrühzeit von Tee ist eine Reduktion des EGCG daher unerheblich.[26]
Interaktion mit Milchproteinen
Verschiedene Studien weisen darauf hin, dass die in Milch enthaltenen Proteine (Molkenproteine, Kaseine) mit EGCG und anderen Catechinen reagieren. Eine Senkung des (−)-EGCG Gehalts in grünem Tee bei Zugabe von Milch konnte beobachtet werden.[27][28][29][30]
Mögliche Nebenwirkungen
Ab einer Tagesdosis von 800 mg EGCG sind Leberschäden und Blutdruckerhöhung zu befürchten. Diese waren aber nur bei Verabreichung von EGCG als Nahrungsergänzungsmittel oder als in kontrollierten Studien getestetes Medikament aufgetreten. Solcherlei Effekte werden selbst durch ausgeprägten Konsum des Grüntees in Aufgussform nicht beobachtet, weshalb die europäische Behörde für Lebensmittelsicherheit, EFSA, diese Form des Konsums im Unterschied zu der Verabreichung als Nahrungsergänzungsmittel als gesundheitlich unbedenklich erachtet.[31][32]
Weblinks
- Bundesministerium für Bildung und Forschung: Grüner Tee gegen Multiple Sklerose.
- Werner Hunstein: AL-Amyloidose und EpiGalloCatechin-3-Gallat: 4 Jahre und 5 Monate später. Stand: Februar 2011
Literatur
- H. Tachibana: Green tea polyphenol sensing. In: Proceedings of the Japan Academy. Band 87, Nummer 3, 2011, S. 66–80, PMID 21422740. PMC 3066547 (freier Volltext). (Review).
- D. Chen, S. B. Wan u. a.: EGCG, green tea polyphenols and their synthetic analogs and prodrugs for human cancer prevention and treatment. In: Advances in clinical chemistry. Band 53, 2011, S. 155–177, PMID 21404918. (Review).
- N. Khan, V. M. Adhami, H. Mukhtar: Review: green tea polyphenols in chemoprevention of prostate cancer: preclinical and clinical studies. In: Nutrition and Cancer. Band 61, Nummer 6, 2009, S. 836–841, doi:10.1080/01635580903285056. PMID 20155624. PMC 2991093 (freier Volltext). (Review).
- Hirofumi Tachibana, Kiyoshi Koga, Yoshinori Fujimura, Koji Yamada: A receptor for green tea polyphenol EGCG. In: Nature Structural & Molecular Biology. April 2004, S. 380–381, doi:10.1038/nsmb743. PMID 15024383.
- Werner Hunstein: Epigallocathechin-3-gallate in AL amyloidosis: a new therapeutic option? In: Blood. Band 110, Nummer 6, September 2007, S. 2216, doi:10.1182/blood-2007-05-089243. PMID 17785589.
Einzelnachweise
- ↑ Eintrag zu EPIGALLOCATECHIN GALLATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ Qianying Dai, Yuanyuan He u. a.: Effect of interaction of epigallocatechin gallate and flavonols on color alteration of simulative green tea infusion after thermal treatment. In: Journal of Food Science and Technology. 54, 2017, S. 2919, doi:10.1007/s13197-017-2730-5.
- ↑ Eintrag zu Epigallocatechin-3-gallat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ a b Datenblatt (−)-Epigallocatechin gallate bei Sigma-Aldrich, abgerufen am 27. Mai 2017 (PDF).
- ↑ J. Steinmann, J. Buer, T. Pietschmann, E. Steinmann: Anti-infective properties of epigallocatechin-3-gallate (EGCG), a component of green tea. In: British Journal of Pharmacology. Band 168, Nr. 5, 2013, ISSN 1476-5381, S. 1059–1073, doi:10.1111/bph.12009, PMID 23072320, PMC 3594666 (freier Volltext) – (wiley.com [abgerufen am 30. März 2021]).
- ↑ Y. Zuo, H. Chen, Y. Deng: Simultaneous determination of catechins, caffeine and gallic acids in green, Oolong, black and pu-erh teas using HPLC with a photodiode array detector. In: Talanta. Band 57, Nummer 2, Mai 2002, S. 307–316, PMID 18968631.
- ↑ a b Bhagwat, Seema; Haytowitz, David B.; Holden, Joanne M. (September 2011).: USDA Database for the Flavonoid Content of Selected Foods, Release 3 (PDF) (Report). (PDF) Agricultural Research Service, U.S. Department of Agriculture, September 2011, abgerufen am 18. Mai 2015 (englisch).
- ↑ ndr.de: Gesunde alte Apfelsorten - auch für Allergiker, 9. September 2014.
- ↑ a b H. Xu, C. M. Becker u. a.: Green tea epigallocatechin-3-gallate inhibits angiogenesis and suppresses vascular endothelial growth factor C/vascular endothelial growth factor receptor 2 expression and signaling in experimental endometriosis in vivo. In: Fertility and Sterility. Band 96, Nummer 4, Oktober 2011, S. 1021–1028.e1, doi:10.1016/j.fertnstert.2011.07.008. PMID 21821246.
- ↑ M. W. Laschke, C. Schwender u. a.: Epigallocatechin-3-gallate inhibits estrogen-induced activation of endometrial cells in vitro and causes regression of endometriotic lesions in vivo. In: Human Reproduction. Band 23, Nummer 10, Oktober 2008, S. 2308–2318, doi:10.1093/humrep/den245. PMID 18603648.
- ↑ a b H. Y. Shin, S. H. Kim, H. J. Jeong, S. Y. Kim, T. Y. Shin, J. Y. Um, S. H. Hong, H. M. Kim: Epigallocatechin-3-gallate inhibits secretion of TNF-alpha, IL-6 and IL-8 through the attenuation of ERK and NF-kappaB in HMC-1 cells. In: International Archives of Allergy and Immunology. November 2006, PMID 17135765.
- ↑ Takako Kondo, Toshiro Ohta, Koichi Igura, Yukihiko Hara, Kazuhiko Kaji: Tea catechins inhibit angiogenesis in vitro, measured by human endothelial cell growth, migration and tube formation, through inhibition of VEGF receptor binding. In: Cancer Letters. Band 180, Nr. 2, 2002, S. 139–144, doi:10.1016/S0304-3835(02)00007-1.
- ↑ B. H. Zhu, W. H. Zhan, Z. R. Li, Z. Wang, Y. L. He, J. S. Peng, S. R. Cai, J. P. Ma, C. H. Zhang: (–)-Epigallocatechin-3-gallate inhibits growth of gastric cancer by reducing VEGF production and angiogenesis. In: World journal of gastroenterology : WJG. Band 13, Nummer 8, Februar 2007, S. 1162–1169. PMID 17451194.
- ↑ M. E. Widlansky, N. M. Hamburg u. a.: Acute EGCG supplementation reverses endothelial dysfunction in patients with coronary artery disease. In: Journal of the American College of Nutrition. Band 26, Nummer 2, April 2007, S. 95–102. PMID 17536120.
- ↑ M. Lorenz, S. Wessler, E. Follmann, W. Michaelis, T. Düsterhöft, G. Baumann, K. Stangl, V. Stangl: A constituent of green tea, epigallocatechin-3-gallate, activates endothelial nitric oxide synthase by a phosphatidylinositol-3-OH-kinase-, cAMP-dependent protein kinase-, and Akt-dependent pathway and leads to endothelial-dependent vasorelaxation. In: Journal of Biological Chemistry. Februar 2004, PMID 14645258.
- ↑ M. Nihal, C. T. Roelke, G. S. Wood: Anti-melanoma effects of vorinostat in combination with polyphenolic antioxidant (−)-epigallocatechin-3-gallate (EGCG). In: Pharmaceutical Research. Juni 2010, PMID 20232120.
- ↑ a b D. E. Ehrnhoefer, J. Bieschke, A. Boeddrich, M. Herbst, L. Masino, R. Lurz, S. Engemann, A. Pastore, E. E. Wanker: EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. In: Nature Structural & Molecular Biology. Juni 2008, PMID 18511942.
- ↑ K. Rezai-Zadeh, G. W. Arendash u. a.: Green tea epigallocatechin-3-gallate (EGCG) reduces beta-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice. In: Brain Research. Band 12, Nr. 1214, Juni 2008, S. 177–186, PMID 18457818.
- ↑ F. Jiang, W. Chen, K. Yi, Z. Wu, Y. Si, W. Han, Y. Zhao: The evaluation of catechins that contain a galloyl moiety as potential HIV-1 integrase inhibitors. In: Clin Immunol. Dezember 2010, PMID 20832370.
- ↑ X. Xiao, Z. Q. Yang, L. Q. Shi, J. Liu, W. Chen: [Antiviral effect of epigallocatechin gallate (EGCG) on influenza A virus]. In: Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica. Band 33, Nummer 22, November 2008, S. 2678–2682. PMID 19216171.
- ↑ O. Aktas, T. Prozorovski, A. Smorodchenko, N. E. Savaskan, R. Lauster, P. M. Kloetzel, C. Infante-Duarte, S. Brocke, F. Zipp: Green tea epigallocatechin-3-gallate mediates T cellular NF-kappa B inhibition and exerts neuroprotection in autoimmune encephalomyelitis. In: Journal of Immunology. November 2004, PMID 15494532.
- ↑ Bremst grüner Tee Entzündungsprozesse im Zentralen Nervensystem? Artikel von der Deutschen Multiple Sklerose Gesellschaft.
- ↑ K. W. Lee, H. J. Lee: The roles of polyphenols in cancer chemoprevention. In: BioFactors. Band 26, Nummer 2, 2006, S. 105–121, PMID 16823097. (Review).
- ↑ G. Korte, A. Dreiseitel, P. Schreier, A. Oehme, S. Locher, S. Geiger, J. Heilmann, P. G. Sand: Tea catechins' affinity for human cannabinoid receptors. In: Phytomedicine. Band 17, Nummer 1, Januar 2010, S. 19–22, doi:10.1016/j.phymed.2009.10.001. PMID 19897346.
- ↑ Jan Hintzpeter, Claudia Stapelfeld, Christine Loerz, Hans-Joerg Martin, Edmund Maser: Green Tea and One of Its Constituents, Epigallocatechine-3-gallate, Are Potent Inhibitors of Human 11β-hydroxysteroid Dehydrogenase Type 1. In: PLOS ONE. 9, 2014, S. e84468, doi:10.1371/journal.pone.0084468.
- ↑ R. Wang, W. Zhou, X. Jiang: Reaction kinetics of degradation and epimerization of epigallocatechin gallate (EGCG) in aqueous system over a wide temperature range. In: Journal of Agricultural and Food Chemistry. Band 56, Nummer 8, April 2008, S. 2694–2701, doi:10.1021/jf0730338. PMID 18361498.
- ↑ Imed Hasni, Philippe Bourassa, Saber Hamdani, Guy Samson u. a.: Interaction of milk α- and β-caseins with tea polyphenols. In: Food Chemistry. Band 126, Nr. 2, Mai 2011, S. 630–639, doi:10.1016/j.foodchem.2010.11.087.
- ↑ C. D. Kanakis, Imed Hasni u. a.: Milk β-lactoglobulin complexes with tea polyphenols. In: Food Chemistry. Band 127, Nr. 3, August 2011, S. 1046–1055, doi:10.1016/j.foodchem.2011.01.079.
- ↑ Elisabeth Jöbstl, Jonathan R. Howse u. a.: Noncovalent Cross-Linking of Casein by Epigallocatechin Gallate Characterized by Single Molecule Force Microscopy. In: J. Agric. Food Chem. 54 (12), 2006, S. 4077–4081, doi:10.1021/jf053259f
- ↑ F. Catterall, A. I. Kassimi, M. N. Clifford, C. Ioannides: Influence of milk on the antimutagenic potential of green and black teas. In: Anticancer Research. 23(5A), Sep-Oct 2003, S. 3863–3867. PMID 14666689
- ↑ EFSA bewertet Sicherheit von Grünteekatechinen. 18. April 2018, abgerufen am 20. April 2019.
- ↑ Jesus Lovera, Alexander Ramos, Deidre Devier, Virginia Garrison, Blake Kovner: Polyphenon E, non-futile at neuroprotection in multiple sclerosis but unpredictably hepatotoxic: Phase I single group and phase II randomized placebo-controlled studies. In: Journal of the Neurological Sciences. Band 358, Nr. 1-2, November 2015, S. 46–52, doi:10.1016/j.jns.2015.08.006 (elsevier.com [abgerufen am 20. April 2019]).