Hyperlipoproteinämie
| Klassifikation nach ICD-10 | |
|---|---|
| E78 | Störungen des Lipoproteinstoffwechsels und sonstige Lipidämien |
| E78.0 | Reine Hypercholesterinämie |
| E78.1 | Reine Hypertriglyzeridämie |
| E78.2 | Gemischte Hyperlipidämie |
| E78.3 | Hyperchylomikronämie |
| E78.6 | Lipoproteinmangel |
| ICD-10 online (WHO-Version 2019) | |
Unter Hyperlipoproteinämie (HLP) oder Hyperlipidämie versteht man allgemein eine erhöhte Konzentration des Cholesterins, der Triglyceride und der Lipoproteine mit Verschiebung des relativen Anteils der LDL- bzw. VLDL-Fraktion im Blut.
Man unterscheidet zwischen primären und sekundären Hyperlipoproteinämien. Primäre Hyperlipoproteinämien stellen eine eigene, meist genetisch bedingte Erkrankung dar, während sekundäre Hyperlipoproteinämien Folgeerscheinungen von anderen Grunderkrankungen sind. Die meisten Patienten mit einer Hyperlipoproteinämie weisen eine Kombination aus genetischer Prädisposition (oft polygen, siehe Punkt 1) und externen Faktoren (Lebensführung, Krankheiten oder Medikamente, siehe Punkt 2) auf.
Störungen des Lipoproteinstoffwechsels zählen in Deutschland zu den am häufigsten diagnostizierten Krankheiten.[1]
Primäre Hyperlipoproteinämien
Die primären Hyperlipoproteinämien können anhand der Klassifikation nach Fredrickson unterschieden werden. Es werden die Werte für Gesamtcholesterin, LDL-Cholesterin und HDL-Cholesterin sowie die Triglyceride berücksichtigt. Die Färbung des Nüchternserums und das Ergebnis der Gelelektrophorese (Lipid-Elektrophorese) gehen ebenfalls in die Klassifikation ein. Zu beachten ist, dass die Fredrickson-Klassifikation kein Lipoprotein a und nicht die genetischen Ursachen, welche den Hyperlipoproteinämien zugrunde liegen, berücksichtigt.
HLP Typ 1 (Exogene Hyperlipidämie, Hyperchylomikronämie)
Selten; autosomal rezessiv vererbt; Defekt der posthepatischen Lipoproteinlipase; stark verzögerter Abbau der Chylomikronen; es kommt zu einer pathologischen Ablagerung von Lipiden in Leber, Milz und in der Haut (Xanthome). Bei der HLP Typ 1 besteht kein erhöhtes Risiko für Arteriosklerose.
Die HLP Typ 1 zeichnet sich im Labor durch normale Gesamtcholesterinwerte und erhöhte Triglyceride aus. LDL-Cholesterin und HDL-Cholesterin sind niedriger als die Referenzwerte. Das Nüchternserum ist unten klar und zeigt sich an der Oberfläche "aufrahmend". Bei der Gelelektrophorese ist die Bande der Chylomikronen sehr deutlich, die anderen Banden (beta, prä-beta und alpha) immer noch deutlich zu erkennen.
HLP Typ 2 (Familiäre Hyperlipidämie, Hypercholesterinämie)
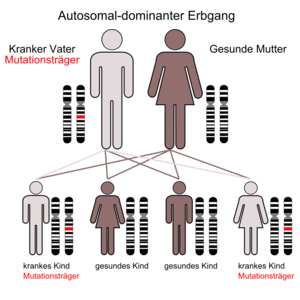
Häufig; autosomal dominant vererbt; Defekt des LDL-Rezeptors infolge einer Mutation des Rezeptorgens (auf Chromosom 19); da LDL nicht bzw. nur in geringem Maß in die Leber aufgenommen werden kann, kommt es zu erhöhten LDL-Cholesterinwerten im Blut. Zudem geht durch die fehlende Aufnahme des LDL in die Leber die Rückkopplungshemmung der Cholesterinsynthese verloren, was zu einer exzessiven VLDL-Synthese der Leber führt. Das daraus gebildete LDL erhöht den Serumcholesterinspiegel massiv.
Bei HLP Typ 2a, der familiären Hypercholesterinämie, kommt es zu einer isolierten Erhöhung von LDL mit den oben beschriebenen Folgen, während bei Typ 2b, der gemischten Hyperlipidämie, zusätzlich auch die Triglyceride leicht erhöht sind. Dies ist wahrscheinlich durch eine Überproduktion von ApoB bedingt, wodurch die VLDL-Bildung gesteigert wird.
Typ 2a zeichnet sich im Gegensatz zu Typ 1 durch erhöhte Gesamtcholesterinwerte und normale Triglyceridwerte aus. Das LDL-Cholesterin ist erhöht, das HDL-Cholesterin oft erniedrigt bis normal. Das Nüchternserum ist klar. Eine Gelelektrophorese zeigt die Banden alpha und prä-beta. Xanthome sind tendinös/tuberös.
Typ 2a wird zu 85 bis 90 Prozent durch Mutationen des LDL-Rezeptor-Genes verursacht, wobei mehr als 1.600 verschiedene Mutationen beschrieben wurden. Abhängig davon ob der Gendefekt nur eines oder beide homologen Chromosomen betrifft, unterscheidet man zwischen einer heterozygoten oder einer homozygoten Form der familiären Hypercholesterinämie. Die sehr viel häufigere, heterozygote familiäre Hypercholesterinämie liegt vor, wenn der Gendefekt nur von einem Elternteil vererbt wurde. Ihre geschätzte Prävalenz liegt bei 1:500. Bei der homozygoten familiären Hypercholesterinämie (HoFH) wird der Gendefekt dem Kind von beiden Elternteilen vererbt. Im Allgemeinen wird von einer Prävalenz von etwa 1:1.000.000 ausgegangen. Da bei homozygoten Individuen die defekten Allele von beiden Eltern ererbt werden, zeigt die Erkrankung eine besonders starke Ausprägung. Patienten mit HoFH bekommen schon im Kindesalter massive Arteriosklerose und Durchblutungsstörungen und erleiden früh Herzinfarkte. Langfristig kommt es meist zu Xanthomen in Haut (kutanös) und Sehnen (tendinös) sowie zu einer früh einsetzenden kardiovaskulären Erkrankung mit entsprechend verkürzter Lebenserwartung. Da die Hypercholesterinämie als Risikofaktor für kardiovaskuläre Ereignisse gilt, ist eine medikamentöse Behandlung für solche Patienten meistens sinnvoll. Besonders wichtig ist es, Patienten der Hoch- und Höchstrisikogruppen auf ihre individuellen Zielwerte zu bringen.[2]
Typ 2b hat sowohl erhöhte Gesamtcholesterinwerte als auch erhöhte Triglyceridwerte. LDL-Cholesterin ist erhöht, HDL-Cholesterin oft erniedrigt. In der Gelelektrophorese zeigen sich starke beta- und prä-beta-Banden, die alpha-Bande ist sichtbar. Das Nüchternserum ist leicht trüb. Xanthome sind tendinös und tuberös.
HLP Typ 3 (Remnant Hyperlipidämie, Broad-beta-Disease)
Sehr selten; autosomal rezessiv vererbt; abnormes Apolipoprotein E führt zu unvollständigem Abbau der Chylomikronenremnants und der IDL, sodass deren Plasmakonzentrationen ansteigen. Folgen sind ein massiv erhöhtes Arterioskleroserisiko.
Typ 3 weist wie auch Typ 2b erhöhte Gesamtcholesterinwerte und Triglyceride im Labor auf. LDL-Cholesterin ist oft normal bis leicht erhöht. HDL-Cholesterin meist erniedrigt. In der Gelelektrophorese zeigt sich eine deutliche prä-beta-Bande und eine leichtere alpha-Bande. Prä-β- und β-Fraktion sind zu einer breiten "Bande" verschmolzen. Das Nüchternserum ist trüb.
HLP Typ 4 (Endogene Hyperlipidämie, Hypertriglyceridämie)
Häufig; autosomal dominant vererbt; es liegt eine Überproduktion endogener Triglyceride sowie eine verminderte Verwertung von VLDL-Triglyceriden vor, was zu einer VLDL-Erhöhung führt. Folgen sind Oberbauchkoliken (aufgrund von Pankreatitis), erhöhtes Arterioskleroserisiko, Übergewicht, Fettleber, Hyperurikämie (erhöhter Harnsäurespiegel, was zu Gicht führen kann) u. v. m.
Typ 4 zeigt im Labor ein normales bis leicht erhöhtes Gesamtcholesterin und deutlich erhöhte Triglyceridwerte. LDL-Cholesterin ist meist normal, HDL-Cholesterin oft erniedrigt. Das Nüchternserum ist trüb. Die Gelelektrophorese weist eine deutliche prä-beta-Bande und eine schwächere beta- und alpha-Bande auf.
HLP Typ 5 (Kombinierte Hyperlipidämie, endogen-exogene-Hypertriglyceridämie)
Die Pathogenese der HLP Typ 5 ist unklar. Die Folgen sind Übergewicht, Fettleber, Hepatosplenomegalie, Oberbauchkoliken und Xanthome der Haut. Das Arterioskleroserisiko ist nicht erhöht.
Typ 5 zeigt im Labor normale bis erhöhte Gesamtcholesterinwerte und erhöhte Triglyceridwerte. LDL-Cholesterin ist meist erhöht, HDL-Cholesterin oft erniedrigt. Das Nüchternserum ist trüb und aufrahmend. Die Gelelektrophorese zeigt deutliche prä-beta- und Chylomikronenbanden und schwächere beta- und alpha-Banden.
Sekundäre Hyperlipoproteinämien
Als Ursachen der sekundären Hyperlipoproteinämien werden folgende Grunderkrankungen genannt:
- Alkoholismus
- Überernährung
- Fehlernährung
- Nephrotisches Syndrom
- Pankreatitis
- Lebererkrankungen
- Cholestase
- Diabetes mellitus
- Hyperurikämie
- Hypothyreose
- Akromegalie
- Glykogenosen
- Hyperkalzämie
Auch durch die Einnahme von Ovulationshemmern und durch eine Schwangerschaft kann vorübergehend eine Hyperlipoproteinämie entstehen. In der Regel erfolgt die Heilung der sekundären Hyperlipoproteinämien durch die Behandlung der jeweiligen Grundkrankheit.
Literatur
- Regine Witkowski u. a.: Lexikon der Syndrome und Fehlbildungen. Ursachen, Genetik und Risiken. 7. Auflage. Springer Verlag, Berlin 2004, ISBN 3-540-44305-3, S. 579ff.
Einzelnachweise
- ↑ Häufigste Diagnosen in Praxen: Gesundheitsberichterstattung des Bundes.
- ↑ ESC/EAS-Leitlinien 2016: [1].