Grottenolm
| Grottenolm | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
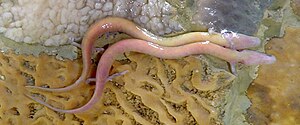
Grottenolme (Proteus anguinus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Proteus | ||||||||||||
| Laurenti, 1768 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Proteus anguinus | ||||||||||||
| Laurenti, 1768 |
Der Grottenolm (Proteus anguinus) ist ein dauernd in Larvenform in Höhlengewässern lebender europäischer Schwanzlurch und die einzige Art der Gattung Proteus. Diese Gattung bildet zusammen mit den nordamerikanischen Furchenmolchen die Familie der Olme (Proteidae). Ähnlichkeiten und konvergente Entwicklungen zum Grottenolm finden sich außerdem bei einigen höhlenbewohnenden Lungenlosen Salamandern, etwa dem Texanischen Brunnenmolch (Eurycea rathbuni).
Merkmale
Der Grottenolm hat einen aalähnlich gestreckten Körper, der eine Länge von 25 bis 30 Zentimetern (in Einzelfällen bis zu 40 Zentimeter) erreichen kann. Der Ruderschwanz ist seitlich abgeflacht und mit Flossensäumen versehen. Die Gliedmaßen sind sehr dünn und reduziert – an den Vorderbeinen befinden sich nur je drei Finger, an den Hinterbeinen je zwei Zehen. Die Haut ist gelblich-weiß, durch durchscheinende Blutgefäße rosa-fleischfarben wirkend, oft mit dunklen Flecken; unter Lichteinfall kann es zu einer dunklen Pigmentierung kommen.
Der Kopf ist länglich-schmal und vorne spatelförmig, die Augen sind bei der Nominatform Proteus anguinus anguinus zur Funktionslosigkeit degeneriert und unter der Körperhaut verborgen. Die Atmung erfolgt durch Lungen; zusätzlich besitzen Grottenolme aber zeitlebens drei Paare äußerer, roter Kiemenbüschel am Hinterkopf. Dieses Phänomen, dass geschlechtsreife, fortpflanzungsfähige Tiere auch Larvenmerkmale aufweisen und behalten, wird als Neotenie oder auch Pädomorphose bezeichnet. Neotenie tritt bei vielen Schwanzlurchen zumindest gelegentlich oder zeitweise auf; bei Grottenolmen ist sie, wie beim Axolotl, obligat. Eine vollständige Metamorphose würde zumindest innerhalb der Höhlenlebensräume vermutlich keinen evolutionären Vorteil bringen. Beide Geschlechter besitzen im geschlechtsreifen Zustand eine verdickte Kloakenregion, daran sind fortpflanzungsbereite Tiere sicher erkennbar. Die Schwellung ist beim Männchen ausgeprägter als beim Weibchen; beim Weibchen sind meist durch die Haut durchschimmernd die Eier erkennbar.
Schwarze Grottenolme in Südslowenien
In zwei benachbarten Quellen in Jelševnik nahe Črnomelj, in der Region Bela krajina (Südostslowenien), wurde im Jahre 1986 eine einzelne oberirdisch lebende Population des Grottenolms entdeckt.[1] Die Tiere unterscheiden sich von der Nominatform durch die kräftige, schwarze Pigmentierung, entwickelte Augen, einen längeren Rumpf, einen breiteren Schädel mit kürzerem Pflugscharbein (Vomer).[2] Sie wurden als eigene Unterart Proteus anguinus parkelj beschrieben. Der slowenische Name „parkelj“ ist einer der Namen des (christlichen) Teufels, auch als „Krampus“ die aus dem Karneval bekannte schwarze Sagenfigur mit roter Zunge.
Der Status der Population als Unterart ist aber umstritten. Sie könnte entweder eine der noch oberirdisch lebenden Stammform des Grottenolms ähnliche Reliktform sein und wäre dann als Unterart gut charakterisierbar oder aber eine Rückadaption höhlenlebender Grottenolme bei sekundärer Einwanderung in einen belichteten Lebensraum. Nach einer Analyse der Verwandtschaftsverhältnisse anhand der Sequenz der mitochondrialen DNA ist die Oberflächenform nicht gegenüber anderen Populationen differenzierbar, sondern gruppiert mit weiteren, typischen, Populationen der geographischen Region.[3] Es ist auch schon seit längerem bekannt, dass Grottenolme an Licht adaptieren können und bei (vorsichtiger und langsam gesteigerter) Belichtung eine dunkle Pigmentierung ausbilden (sie sind also nicht, wie oft ungenau unterstellt wird, albinotisch). Der österreichische Forscher Paul Kammerer berichtet außerdem bereits 1912, dass es ihm gelungen sei, unter Rotlichtbestrahlung die rudimentären und normalerweise funktionslosen[4] Augen zur funktionalen Differenzierung anzuregen.[5] Demnach besteht die Möglichkeit, dass normale, dunkeladaptierte Grottenolme noch die genetische Potenz besitzen, sich bei der Einwanderung in belichtete Lebensräume an diese Bedingungen zu adaptieren. Wenn dieses Szenario zuträfe, würde die typische Unterart durch die neue Unterart parkelj paraphyletisch; diese wäre dann nicht gerechtfertigt.
Verbreitung
Der Grottenolm lebt ausschließlich im dinarischen Karst, im Kalkgebirge östlich der Adria. Die Verbreitung reicht vom äußersten Nordosten Italiens (im Einzugsgebiet des Flusses Isonzo/Soča mit absoluter Nordgrenze in Gradisca d’Isonzo[6]) über Slowenien und das westliche Kroatien (unter Einschluss der Halbinsel Istrien) bis zur Trebišnjica in der Herzegowina. Die besiedelten Gewässer entwässern zum Teil zur Adria, andere über Save und Donau zum Schwarzen Meer. Dies ist aber teilweise schwer feststellbar, weil das Gebiet vor allem unterirdisch entwässert und zahlreiche Gewässer in Ponoren im Untergrund verschwinden. Das am weitesten landeinwärts vorgeschobene Vorkommen liegt etwas isoliert von den anderen im Lusci Polje in der bosnischen Krajina.[7] Da die Art erhebliche öffentliche Aufmerksamkeit genießt und neu gemeldete Vorkommen meist unmittelbar intensiv überprüft werden, gilt die Entdeckung völlig neuer Vorkommen der Art als unwahrscheinlich. Es wird aber angenommen, dass der wesentliche Lebensraum für den Menschen unzugängliche Klüfte im Karstgestein sind. Funde aus dem Menschen zugänglichen größeren Höhlen oder Quellen sind vermutlich nur randliche oder von Flutwasser ausgeschwemmte Vorkommen. Wie das Vorkommen der oberirdischen, dunkel pigmentierten Population beweist, können sie aber unter günstigen Umständen hier auch dauerhaft leben. Die Höhenverbreitung ist wegen der unterirdischen Lebensweise schwer anzugeben. So lebt keine der italienischen Populationen höher als 20 m, teilweise aber unter den Karsthöhenzügen mehr als 300 Meter unter der Geländeoberfläche.[6]
Seit langer Zeit gibt es Versuche des Menschen, Grottenolme außerhalb ihres natürlichen Areals in Höhlen neu anzusiedeln. Neben dem Vorkommen in Moulis in den französischen Pyrenäen geht auch die Population in Oliero Valstagna in der italienischen Provinz Vicenza auf eine Aussetzung bereits im 19. Jahrhundert zurück.[6] Meist kam es dabei aber nicht zur Fortpflanzung.
Grottenolme in der Hermannshöhle
In Deutschland ist die Hermannshöhle im Harz bei Rübeland (Sachsen-Anhalt) bekannt für ihre Grottenolme. Insgesamt 18 aus Istrien stammende Exemplare wurden dort in den Jahren 1932 (5 Stück) und 1956 (13 Stück) zu Schauzwecken in einem künstlichen Höhlengewässer ausgesetzt, das eine Tiefe von rund 80 Zentimetern und eine permanente Wassertemperatur von 7 °C aufweist. Dieser sogenannte „Olmensee“ stellt eine Touristenattraktion dar.[8] Im Jahr 1978 wurde ein Zuchtbecken gebaut. Eine bei der Gelegenheit vorgenommene Bestandsaufnahme konnte nur männliche Tiere feststellen; auch 1985 schienen alle 13 erfassten Exemplare männlich zu sein. 2015 wurden nur noch 9 Tiere gefunden. Von diesen waren aber 5 Weibchen, die auch Eier trugen.[9] Erstmals nach 85 Jahren wurden 2016 4 Eier gefunden, die in gesonderte Becken überführt wurden, damit sie sich störungsfrei entwickeln können.[10] Nicht selten kommt es nämlich vor, dass Grottenolme ihre eigenen Eier vertilgen.[11] Zunächst war man davon ausgegangen, dass, sollten die Eier befruchtet sein, im Mai oder Juni 2016 bereits Jungtiere zu finden wären.[11] Anfang Juni gab die zuständige Projektleiterin bekannt, dass sich der Schlupf verzögere, da die Höhle weit im Norden liegt und dies die Entwicklung der Tiere verlangsame.[12] Tatsächlich starben alle Eier ab. Im August 2017 wurden erneut zehn Eier entdeckt und separiert. Auch diese starben ab.[13] 2020 entdeckte man bei einem Bestand von 7 Exemplaren bei einem der 4 Weibchen 4 befruchtete Eier im Eileiter.[14] Ende August 2020 wurde zwei Gelege mit Eiern entdeckt.[15]
Lebensraum, Lebensweise
Die Art lebt in überfluteten Teilen von Höhlen (von Höhlenkundlern Siphon genannt), selten auch in aus solchen Höhlengewässern gespeisten Karstquellen oder in offenen Höhlenseen. Bei Nutzung des Karstgrundwassers werden sie manchmal mit dem Pumpen nach oben befördert,[6] außerdem gibt es (unbestätigte) alte Berichte, dass sie gelegentlich nachts aus den Höhlengewässern in Quellen und Oberflächengewässer aufwandern. Grottenolme können sowohl Luft atmen wie auch ihren Sauerstoffbedarf im Wasser über Kiemen und Hautatmung decken, bei Haltung in Terrarien verlassen sie manchmal das Wasser freiwillig, auch für längere Zeit,[16] sie können hier sogar jagen. Die Tiere suchen Verstecke in Spalten oder unter Steinen auf, graben sich aber nie ein. Sie kehren dabei immer wieder in bekannte Schlupfwinkel zurück, die sie am Geruch erkennen;[17] im Experiment bevorzugten dabei zumindest sexuell inaktive Tiere von Artgenossen bereits besetzte Schlupfwinkel, sind also gesellig. Die Aktivität der Art ist, dem unterirdischen Lebensraum angemessen, weder tages- noch jahresperiodisch; sogar Jungtiere können zu allen Jahreszeiten gleichermaßen gefunden werden. Grottenolme können, obwohl ihre Augen funktionslos sind, über einen Hautlichtsinn Licht wahrnehmen.[4][16][18] Werden einzelne Körperteile stärker belichtet, fliehen sie vom Licht weg (negative Phototaxis). Sie können sich aber an andauernde Lichtreize gewöhnen und werden von extrem schwacher Belichtung sogar angelockt. Sie können sich außerdem über einen magnetischen Sinn im Lebensraum orientieren.[18]
Zum Vorzugshabitat der Art gibt es zum Teil widersprüchliche Angaben. Während manche Forscher von einer Bevorzugung besonders tiefer, ungestörter Gewässerteile mit konstanten Umweltbedingungen ausgehen, vermuten andere eine Bevorzugung von Bereichen mit einströmendem Oberflächenwasser, weil hier das Nahrungsangebot wesentlich besser ist. Soweit bekannt, jagen sie unspezifisch im Lebensraum anzutreffende kleine Krebstiere wie Wasserasseln, Flohkrebse (Gammarus und den Höhlenflohkrebs Niphargus) und die kleine höhlenlebende Süßwassergarnele Troglocaris, außerdem Würmer (Oligochaeten). Im Experiment sind sie wenig wählerisch und fressen alles, was sie überwältigen können.[16] Zu natürlichen Feinden des Grottenolms ist wenig bekannt. Wolfgang Briegleb vermutet, dass die Art nicht in Gewässern leben kann, in denen Flusskrebse vorkommen. Ein spezialisierter Parasit, Chloromyxum protei Joseph, 1905 (Myxozoa), der in der Niere parasitiert, ist bisher ausschließlich aus dieser Art nachgewiesen.[19][20]
Der Grottenolm ist relativ temperaturempfindlich. Beim Vergleich von ihm besiedelter Gewässer zeigt sich, dass er (mit sehr seltenen Ausnahmen) nur Gewässer wärmer als 8 °C besiedelt und solche über 10 °C bevorzugt,[7] obwohl er tiefere Temperaturen, bis hin zu Eis, über kürzere Zeiten zu tolerieren vermag.[16] Wassertemperaturen bis etwa 17 °C werden ohne Probleme toleriert, noch wärmeres Wasser nur noch für kurze Zeiten. Oberhalb 18 °C ist keine Entwicklung von Eiern und Larven mehr möglich. Im Grundwasser und in Höhlengewässern ist, abseits einströmenden Oberflächenwassers, die Temperatur im Jahresverlauf nahezu konstant und entspricht in etwa der Jahresmitteltemperatur an diesem Ort. Möglicherweise ist also seine Verbreitung sowohl in der Höhe wie auch nach Norden hin durch Isothermen begrenzt. Obwohl die besiedelten Gewässer meist mit Sauerstoff mehr oder weniger gesättigt sind, toleriert der Grottenolm einen weiten Wertebereich und vermag sogar völliges Fehlen von Sauerstoff, Anoxie genannt, bis zu 12 Stunden zu überleben.[21]
Fortpflanzung und Entwicklung
Durch seine Lebensweise in Klüften im Karstgestein war es bis heute nicht möglich, die Entwicklung des Grottenolms in seinem natürlichen Habitat zu untersuchen. So sind bis heute noch niemals Eier im eigentlichen Lebensraum gefunden worden, und selbst jüngere Larvenstadien nur extrem selten. Bei der einzigen Beobachtung von Eiern, in einer Karstquelle, ist von einer Verschleppung durch Flutwasser auszugehen.[22] In der berühmten Schauhöhle von Postojna, aus der die Art seit über 100 Jahren bekannt ist, wurden 2014 im Schauaquarium des Besucherbereichs erstmals Eier gefunden[23], Ende Mai 2016 wurde der Schlupf zweier Tiere beobachtet[24].
Zur Entwicklung des Grottenolms liegen, neben Aquariumsbeobachtungen, heute auch Daten aus der künstlich begründeten Population aus der Höhle von Moulis in den französischen Pyrenäen vor, wo die Daten zur Population seit 1958 dokumentiert worden sind.[25] Demnach erreichen Weibchen die Geschlechtsreife erst im Alter von durchschnittlich 15 bis 16 Jahren und reproduzieren auch dann nur selten, in Moulis alle 12,5 Jahre. Bei Hälterung von Wildfängen im Aquarium erreichen relativ viele Tiere innerhalb einiger Monate die Geschlechtsreife, dies wird mit der besseren Ernährung in Zusammenhang gebracht.[16] Männchen besetzen im Lebensraum Balzreviere von (im Aquarium) etwa 80 Zentimeter Durchmesser, dessen Rand es fortwährend patrouilliert. Kommen andere begattungsbereite Männchen in dieses Balzrevier, kommt es zu heftigen Revierkämpfen, wobei der Revierinhaber den Rivalen durch Bisse attackiert; dabei können durchaus Wunden zugefügt oder Kiemen abgebissen werden. Nicht geschlechtsreife Tiere werden im Revier geduldet. Die Tiere können dabei das Geschlecht und den Fortpflanzungsstatus von Artgenossen nur bei direktem Körperkontakt erkennen.[26] Schwimmt ein geschlechtsreifes Weibchen ins Revier ein, wird es vom Männchen unter Schwanzwedelbewegungen umkreist. Schließlich setzt das Männchen am Gewässergrund eine Spermatophore ab. Das Weibchen streicht mit ihrer Kloake darüber und nimmt dabei Spermien auf. Diese Sequenz kann mehrfach hintereinander abfolgen. Schließlich verlässt das Weibchen das Balzrevier und sucht einen Schlupfwinkel auf. Hier oder in dessen Nähe besetzt sie anschließend ein Laichrevier, dessen Grenzen sie ebenfalls mit Bissen gegen Eindringlinge verteidigt. Dabei werden auch weitaus größere Artgenossen attackiert. Die Ablage der etwa 4 Millimeter großen Eier beginnt etwa 2 bis 3 Tage später und zieht sich oft über einige Wochen hin.[16] Die Gelegegröße wird für Moulis mit 35 Eiern angegeben, von denen etwa 40 Prozent schlüpften. Im Aquarium legte ein Weibchen etwa 70 Eier über einen Zeitraum von 3 Tagen verteilt ab. Das Weibchen verteidigt das Laichrevier mit den Jungen auch nach deren Schlupf. Unbewachte Eier und Junglarven werden von anderen Olmen ohne weiteres gefressen. Die Larven beginnen ihr aktives Leben mit etwa 31 Millimeter Körperlänge; die Embryonalentwicklung dauert 180 Tage.[27] Die Larven unterscheiden sich von ausgewachsenen Olmen durch die gedrungene, rundliche Körperform, die kleineren Hinterextremitäten und den breiteren Flossensaum, der bei ihnen nach vorn bis über den Rumpf reicht. Die adulte Körperform wird nach 3 bis 4 Monaten erreicht, die Tiere sind dann etwa 4,5 Zentimeter lang.[16]
Mit über 70 Jahren Lebenserwartung (unter halbnatürlichen Bedingungen ermittelt), manche Forscher gehen gar von 100 Jahren aus,[28] kann die Art um ein Vielfaches älter werden, als es bei Amphibien allgemein üblich ist.[25] In der unter halbnatürlichen Bedingungen gehaltenen Population in Moulis wurden Tiere (die als Wildfänge unbekannten Alters eingesetzt worden waren) teilweise über 48 Lebensjahre beobachtet, ohne dass bei den älteren Tieren Seneszenz oder ein Abfall der Lebenserwartung eintrat. Die Forscher kalkulieren aus ihren Lebenstafel-Daten (Regressionsgerade) eine Generationsdauer von 36,5 Jahren und eine durchschnittliche Lebenserwartung von 68,5 Jahren für Tiere in ihrem sechsten Lebensjahr (d. h. ohne Berücksichtigung der Jugendmortalität). Die hohe Lebenserwartung ist für ein Tier mit der geringen Körpermasse des Olms (etwa 20 Gramm) außergewöhnlich und bis heute nicht restlos wissenschaftlich aufgeklärt. Sicherlich spielt der Lebensraum Höhle mit seinen ungünstigen, aber hochgradig vorhersagbaren und gleichförmigen Bedingungen dabei eine Rolle.
Einige Forscher haben Beobachtungen veröffentlicht, nach denen der Grottenolm lebende Junge absetzen würde oder diese unmittelbar nach der Eiablage ausschlüpfen würden (Viviparie bzw. Ovoviviparie).[29] Bei genaueren Untersuchungen wurden allerdings stets Eier abgelegt. Möglicherweise gehen diese Beobachtungen auf unter extrem ungünstigen Bedingungen gehälterte Tiere zurück.
Forschungsgeschichte
In früheren Zeiten wurde der Grottenolm aufgrund seines Äußeren für ein Drachenjunges gehalten. Wegen seiner hautähnlichen Körperfarbe wird er auch „Menschenfischlein“ genannt – dies ist die Übersetzung seiner Namen in kroatischer (čovječja ribica), serbischer (Човечја рибица) und slowenischer (človeška ribica) Sprache. Ein Taufstein aus der Kirche San Nicolò in Venedig aus dem 10. oder 11. Jahrhundert, der heute im Kunsthistorischen Museum in Wien aufbewahrt wird, zeigt zwei langgestreckte Tiere, bei denen es sich um Grottenolme handeln könnte.[30]
Die erste publizierte Beschreibung des Grottenolms ist der Bericht von Johann Weichard von Valvasor aus dem Jahr 1689. Dieser hatte von einem Bauern erfahren, dass im Tal der Bela bei Vrhnika ein „Lindwurm“ unter der Erde hause. Auf geäußerte Zweifel berief sich der Bauer auf den Postmeister Hofmann zu Ober-Laybach. Nach Besuch des Postmeisters und eigener Untersuchung des Tiers bemerkt Valvasor, es sei „einer Eydexen gleich geformirt gewest“.[31] Spätere Bearbeiter weisen darauf hin, dass der von Valvasor genannte Fundort unplausibel und vermutlich eine Falschangabe sei. Der erste tatsächliche Fund eines Tiers in einer Höhle gelang Josip Jeršinovič Ritter von Löwengreif, Kreiskassierer in Adelsberg (Postojna), in der „Magdalenengrotte“ (die Črna Jama, Teil der Höhlen von Postojna) im Jahr 1797,[32] später als Typlokalität für die Art festgesetzt. Die wissenschaftliche Erstbeschreibung der Art durch Joseph Nicolai Laurenti 1768 machte dieser nach Tieren aus Stična, die ihm Giovanni Antonio Scopoli zugesandt hatte. Es war die erste Beschreibung einer rein höhlenlebenden (Fachausdruck troglobionten) Tierart weltweit. Der Fund regte die Phantasie einiger der führenden Naturforscher ihrer Zeit an: Damals gefundene Fossilien versteinerter Knochen von Reptilien wurden von Georges Cuvier oder William Kirby höhlenlebenden Proteus-Verwandten zugeschrieben (diese nahmen aus theologischen Gründen an, dass Arten nicht aussterben können, und erklärten das Fehlen lebender Exemplare mit ihrer verborgenen, unterirdischen Lebensweise). Im 19. Jahrhundert wurden Grottenolme in den Höhlen von Postojna an Besucher als Kuriosität und Reisemitbringsel verkauft; so gelangten auch eine Reihe lebender Tiere durch Reisende, darunter bekannte wie Charles Babbage, William John Hamilton oder Francis Galton, nach Nordeuropa, wo die Tiere zum Beispiel im Londoner Zoo gezeigt wurden.[30]
Gefährdung und Schutz
Gefährdung
Der Grottenolm wird von der IUCN in der Roten Liste in der Kategorie „gefährdet“ (vulnerable, vu) aufgeführt (vgl. unter Weblinks). Wesentliche Gefährdungsursachen sind von der Oberfläche ausgehende Wasserverschmutzung der unterirdischen Karstgewässer, auch durch intensivierte Landnutzung oder Urbanisierung und Grundwassernutzung als Brauch- oder Trinkwasser, sowie Wassernutzung zur Elektrizitätserzeugung. Weitere Ursachen wie direkte Verfolgung oder touristischer Ausbau von Höhlen sind nur von untergeordneter Bedeutung. Wegen der hohen Wegsamkeiten in dem klüftigen Gestein ist Karstgrundwasser in besonderer Weise empfindlich gegenüber Verschmutzung.
Zentral im Areal des Grottenolms liegt zum Beispiel die Fabrik der Firma Iskra zur Produktion von Kondensatoren für die Elektroindustrie, die für die massive Grundwasserverschmutzung im Einzugsgebiet der Krupa verantwortlich gemacht wird (vgl. Artikel PCB-Verschmutzung der Krupa). Die giftigen polychlorierten Biphenyle sind auch im Fettgewebe von Grottenolmen aus der Region angereichert.[33] Aber auch die Arsen-Konzentration im Gewebe vieler Olme ist stark erhöht, was auf arsenhaltige Pestizide, vor allem aus dem Weinbau, zurückgeführt wird.[34] Obwohl die Olme die akuten Konzentrationen offenbar überleben, ist wenig über mögliche chronische Wirkungen bekannt. Die Populationsgröße und ein möglicher Populationstrend sind für die Art in keinem Teil ihres Areals bekannt, Grund ist die schwierige und von vielen Zufällen abhängige Nachweisbarkeit der Art. Der Rückgang der italienischen[6] und slowenischen[35] Vorkommen wird daher aus guten Gründen vermutet, ist aber nicht mit Bestandszahlen zu untermauern. Aus Slowenien ist bekannt, dass einige früher individuenreiche Vorkommen in Kočevsko polje (der größten Karstebene in Slowenien) in der Region Kočevje (ehem. Gottschee) durch Abwässer der Industrie und aus einer Deponie erloschen sind.[7] Darüber hinaus liegen keine sicheren Erkenntnisse vor.
Artenschutz
Die Art ist in der Europäischen Union „Art von gemeinschaftlichem Interesse“.[36] Sie ist in der Fauna-Flora-Habitat-Richtlinie in den Anhängen II und IV aufgeführt. Für Arten des Anhangs II sind von den Mitgliedsstaaten eigens besondere Schutzgebiete auszuweisen, die Teil des Schutzgebietssystems Natura 2000 werden sollen. Der Grottenolm ist dabei eine der „prioritären“ Arten, weil die EU für sein Überleben eine besondere Verantwortung besitzt. Arten des Anhangs IV, einschließlich ihrer Lebensräume, sind darüber hinaus überall besonders geschützt, wo sie vorkommen. Bei Vorhaben und Eingriffen in die Natur, die sich auf die Bestände auswirken können, ist vorher nachzuweisen, dass sie den Bestand nicht bedrohen – auch abseits von Schutzgebieten. Die Schutzkategorien der FFH-Richtlinie gelten unmittelbar EU-weit und sind in der Regel, so auch in Deutschland, in die nationale Gesetzgebung aufgenommen worden. Auch in Kroatien, Slowenien und Italien ist der Grottenolm geschützt, in Slowenien ist seit 1982 der Handel mit den Tieren verboten. Die bedeutsamsten Vorkommen des Grottenolms in Slowenien sind inzwischen durch Natura-2000 Schutzgebiete erfasst,[35] wobei aber einige Populationen weiterhin als gefährdet gelten.
Phylogenie, Verwandtschaft, Evolution
Die Gattung Proteus mit dem Grottenolm als einziger Art wird mit der amerikanischen Gattung Necturus in der Familie der Proteidae vereinigt. Die Zusammenfassung aufgrund morphologischer Gemeinsamkeiten galt lange als unsicher und ist wiederholt bestritten worden. Phylogenomische Untersuchungen, anhand homologer DNA-Sequenzen, unterstützen überwiegend die Zusammengehörigkeit, wenn auch teilweise nicht mit überragender statistischer Sicherheit.[37][38][39] Nach den Methoden der molekularen Uhr wird eine Aufspaltung der Linien in der Unterkreide erschlossen; zu diesem Zeitpunkt war der Superkontinent Laurasia noch nicht endgültig in Eurasien und Nordamerika aufgespalten. Das heutige Vorkommen ist also wahrscheinlich ein Relikt einer einstmals weiteren Verbreitung.
Richard Estes und Ilya Darevsky haben einen fossilen Salamander aus dem Miozän des Kaukasus als Mioproteus caucasicus beschrieben, der in die Stammgruppe des rezenten Grottenolms gehören könnte.[40] Sie nehmen aufgrund der Körperproportionen auch für ihn Neotenie an. Im Gegensatz zum rezenten Grottenolm besaß er aber noch eine stabil verknöcherte Wirbelsäule und Rippen. Merkmale der Bezahnung machen es aber unwahrscheinlich, dass er selbst ein Vorfahr des Grottenolms gewesen sein könnte. Aufgrund der Fundumstände und der Begleitfauna nehmen sie ein oberirdisches Gewässer, wahrscheinlich einen See, als Lebensraum an. Überzeugende fossile Funde von Proteus selbst oder möglichen ausgestorbenen Verwandten (Batrachosauroididae) aus den Dinariden liegen keine vor.
Die Entstehung des heutigen Areals des Grottenolms ist noch nicht befriedigend erklärbar. Die Dinariden waren vermutlich seit dem Oligozän Festland. Im heutigen Areal des Grottenolms muss es aber im Eiszeitalter überwiegend zu kalt für eine erfolgreiche Entwicklung von Eiern und Larven gewesen sein. Proteus kommt nicht in Regionen vor, die im Pleistozän vergletschert waren, das nördlichste Vorkommen liegt aber nur etwa 30 Kilometer südlich des extremsten südlichen Eisrands. Möglich ist entweder, dass die Art aus Refugien weiter südlich die Region erst in der Nacheiszeit besiedelt hat, oder dass sie zu diesem Zeitpunkt noch oberirdisch lebte. Direkte Sonneneinstrahlung macht in oberirdischen Gewässern eine Entwicklung eher als in Höhlengewässern möglich, auch wenn die Durchschnittstemperaturen gleich sind.[7]
Sonstiges
Die slowenische Stadt Postojna führt einen nahezu realistisch gezeichneten Grottenolm in ihrem Wappen.
Literatur
- Constantin von Wurzbach: Petsch Ritter von Löwengreif, Joseph. In: Biographisches Lexikon des Kaiserthums Oesterreich. 24. Theil. Kaiserlich-königliche Hof- und Staatsdruckerei, Wien 1872, S. 129 (Digitalisat).
- Dieter Glandt: Taschenlexikon der Amphibien und Reptilien Europas. Quelle & Meyer, Wiebelsheim 2010, ISBN 978-3-494-01470-8.
- Václac Laňka, Zbyšek Vít: Lurche und Kriechtiere. Aus dem Tschechischen übersetzt von Emma Echsnerová. Artia, Prag 1984, S. 52–53.
- Andreas Nöllert, Christel Nöllert: Die Amphibien Europas. Franckh-Kosmos, Stuttgart 1992, ISBN 3-440-06340-2.
Weblinks
- Artikel über Grottenolme aus der FAZ-Sonntagszeitung (PDF-Datei; 24 kB)
- Proteus anguinus bei Amphibiaweb.org
- Proteus anguinus bei Amphibian Species of the World 6.0, an Online Reference
- Proteus anguinus bei EDGE
- Devonkarst.org: The Proteus Project
- Proteus anguinus in der Roten Liste gefährdeter Arten der IUCN 2009. Eingestellt von: Arntzen et al., 2008.
Einzelnachweise
- ↑ Boris Sket, Jan Willem Arntzen: A black, non-troglomorphic amphibian from the karst of Slovenia: Proteus anguinus parkelj n. ssp. (Urodela: Proteidae). In: Bijdragen tot de Dierkunde. 64(1), 1994, S. 33–53.
- ↑ Ana Ivanović, Gregor Aljančič, Jan W. Arntzen: Skull shape differentiation of black and white olms (Proteus anguinus anguinus and Proteus a. parkelj): an exploratory analysis with micro-CT scanning. In: Contributions to Zoology. 82 (2), 2013, S. 107–114, doi:10.1163/18759866-08202004.
- ↑ Špela Gorički, Peter Trontelj: Structure and evolution of the mitochondrial control region and flanking sequences in the European cave salamander Proteus anguinus. In: Gene. 378, 2006, S. 31–41. doi:10.1016/j.gene.2006.04.016
- ↑ a b R. S. Hawes: On the eyes and reactions to light of Proteus anguinus. In: Quarterly Journal of Microscopical Science. 86, 1945, S. 1–53.
- ↑ Peter Berz: The Eyes of the Olms. In: History and Philosophy of the Life Sciences. 31, 2009, S. 215–238.
- ↑ a b c d e Nicola Bressi: Underground and unknown: updated distribution, ecological notes and conservation guidelines on the Olm Proteus anguinus anguinus in Italy (Amphibia, Proteidae). In: Italian Journal of Zoology. 71, Supplement 1, 2004, S. 55–59.
- ↑ a b c d Boris Sket: Distribution of Proteus (Amphibia: Urodela: Proteidae) and its Possible Explanation. In: Journal of Biogeography. Vol. 24, No. 3, 1997, S. 263–280. (Zugriff über JSTOR)
- ↑ Wolf-Rüdiger Grosse: Grottenolm – Proteus anguinus Laurenti, 1768. In: Frank Meyer u. a. (Hrsg.): Die Lurche und Kriechtiere Sachsen-Anhalts. Laurenti-Verlag, Bielefeld 2004, ISBN 3-933066-17-4, S. 191–193.
- ↑ Unter den Olmen der Hermannshöhle sind Weibchen. In: Volksstimme. 22. Januar 2015, abgerufen am 10. September 2015.
- ↑ Sensation: Grottenolme haben Eier gelegt. In: Volksstimme. 26. Februar 2016, abgerufen am 26. Februar 2016.
- ↑ a b Es regt sich was beim Grottenolm. In: Hamburger Abendblatt. 24. März 2016, S. 21.
- ↑ Sagenhafte Olme für jeden sichtbar. In: Volksstimme. 10. Juli 2016, abgerufen am 11. September 2016.
- ↑ Wieder kein Nachwuchs für Harzer Grottenolme. ndr.de, 27. Oktober 2017, abgerufen am 25. April 2018.
- ↑ Wieder Hoffnung auf Grottenolm-Nachwuchs in Tropfsteinhöhle. rtl.de, 6. Juni 2020, abgerufen am 12. Juni 2020.
- ↑ Hoffnung auf Nachwuchs: Befruchtete Grottenolm-Eier gefunden
- ↑ a b c d e f g Wolfgang Briegleb: Zur Biologie und Ökologie des Grottenolms (Proteus anguinus Laur. 1768). In: Zeitschrift für Morphologie und Ökologie der Tiere. 51, 1962, S. 271–334.
- ↑ O. Guillaume: Role of chemical communication and behavioural interactions among conspecifics in the choice of shelters by the cave-dwelling salamander Proteus anguinus (Caudata, Proteidae). In: Canadian Journal of Zoology. 78, 2000, S. 167–173.
- ↑ a b Peter A. Schlegel, Sebastian Steinfartz, Boris Bulog: Non-visual sensory physiology and magnetic orientation in the Blind Cave Salamander, Proteus anguinus (and some other cave-dwelling urodele species). Review and new results on light-sensitivity and non-visual orientation in subterranean urodeles (Amphibia). In: Animal Biology. 59, 2009, S. 351–384. doi:10.1163/157075609X454971
- ↑ H. Joseph: Chloromyxum protei n. sp. In: Zoologischer Anzeiger. 29, 1905, S. 450–451. Volltextquelle über Biostor
- ↑ Jorge C. Eiras: An overview on the myxosporean parasites in amphibians and reptiles. In: Acta Parasitologica. 50(4), 2005, S. 267–275.
- ↑ J. Issartel, F. Hervant, M. de Fraipont, J. Clobert, Y. Voituron: High anoxia tolerance in the subterranean salamander Proteus anguinus without oxidative stress nor activation of antioxidant defenses during reoxygenation. In: Journal of Comparative Physiology. B 179(4), 2009, S. 543–551. doi:10.1007/s00360-008-0338-9. getestet bei 12 °C
- ↑ B. Sket, F. Velkovrh: The discovery of Proteus-eggs (Proteus anguinus Laurenti, Amphibia) in seminatural conditions. In: International Journal of Speleology. 10, 1978, S. 205–209.
- ↑ Miracle in Postojna Cave Aquarium - Proteus anguinus laying eggs (Memento vom 21. August 2014 im Internet Archive)
- ↑ „Die Geburt der Drachen“. Abgerufen am 13. Juni 2016.
- ↑ a b Yann Voituron, Michelle de Fraipont, Julien Issartel, Olivier Guillaume, Jean Clobert: Extreme lifespan of the human fish (Proteus anguinus): a challenge for ageing mechanisms. In: Biological Letters. 7(1), 2010, S. 105–107. doi:10.1098/rsbl.2010.0539
- ↑ Jakob Parzefall: Behavioral ecology of aquatic salamanders colonizing subterranean habitats. In: Proceedings of the 15th International Congress of Speleology. 2009, S. 270–273.
- ↑ Ronald A. Nussbaum: Parental care and egg size in salamanders: an examination of the safe harbor hypothesis. In: Research in Population Ecology. 29, 1987, S. 27–44.
- ↑ Forscher rätseln über Greisenalter des Grottenolms. In: Spiegel online. 21. Juli 2010.
- ↑ Nelson G. Hairston: Community Ecology and Salamander Guilds. Cambridge University Press, 1987, ISBN 0-521-32578-1, S. 85.
- ↑ a b Trevor R. Shaw: Proteus for sale and for science in the 19th Century. In: Acta Carsologica. 28(1), 1999, S. 229–304.
- ↑ Irmgard Palladino, Maria Bidovec: Johann Weichard von Valvasor (1641–1693). Ein Protagonist der Wissenschaftsrevolution der Frühen Neuzeit. Leben, Werk und Nachlass. Böhlau Verlag, Wien 2008, ISBN 978-3-205-77719-9, S. 64.
- ↑ Stephan Kempe, Hans-Peter Hubrich: Inscriptions of some historically known persons in Postojnska jama. In: Acta Carsologica. 49(2), 2011, S. 397–415.
- ↑ Marko Pezdirc, Ester Heath, Lilijana Bizjak Mali, Boris Bulog: PCB accumulation and tissue distribution in cave salamander (Proteus anguinus anguinus, Amphibia, Urodela) in the polluted karstic hinterland of the Krupa River, Slovenia. In: Chemosphere. 84, 2011, S. 987–993. doi:10.1016/j.chemosphere.2011.05.026
- ↑ Boris Bulog, Katarina Mihajl, Zvonka Jeran, Mihael J. Toman: Trace element concentrations in the tissues of Proteus anguinus (Amphibia, Caudata) and the surrounding environment. In: Water, Air, and Soil Pollution. 136, 2002, S. 147–163.
- ↑ a b Andrej Hudoklin: Are we guaranteering the favorable status of the Proteus anguinus in the Natura 2000 Network in Slovenia? In: Mitja Prelovšek, Nadja Zupan Hajna (Hrsg.): Pressures and Protection of the Underground Karst. Cases from Slovenia and Croatia. Založba ZRC, 2011, ISBN 978-961-254-285-6, S. 169–181. Vorschau bei Google Books
- ↑ Grottenolm bei www.wisia.de
- ↑ Peter Trontelj, Spela Goricki: Monophyly of the family Proteidae (Amphibia: Caudata) tested by phylogenetic analysis of mitochondrial 12s rDNA sequences. In: Natura Croatica. Vol. 12, No. 3, 2003, S. 113–120.
- ↑ David W. Weisrock, Luke J. Harmon, Allan Larson: Resolving Deep Phylogenetic Relationships in Salamanders: Analyses of Mitochondrial and Nuclear Genomic Data. In: Systematic Biology. 54(5), 2005, S. 758–777. doi:10.1080/10635150500234641
- ↑ R. Alexander Pyron, John J. Wiens: A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. In: Molecular Phylogenetics and Evolution. 61, 2011, S. 543–583. doi:10.1016/j.ympev.2011.06.012
- ↑ Richard Estes, Ilya Darevsky: Fossil amphibians from the Miocene of the North Caucasus, U.S.S.R. In: Journal of the Paleontological Society of India. vol 20, 1977, S. 164–169.

