Iodosobenzol
| Dieser Artikel wurde auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie formal und inhaltlich auf ein in der Wikipedia gewünschtes Niveau zu bringen. Wir sind dankbar für deine Mithilfe, bitte beteilige dich an der Diskussion (neuer Eintrag) oder überarbeite den Artikel entsprechend. |
| Strukturformel | |||
|---|---|---|---|
| |||
| Allgemeines | |||
| Name | Iodosobenzol | ||
| Andere Namen |
| ||
| CAS-Nummer | 536-80-1 | ||
| EG-Nummer | 208-648-8 | ||
| ECHA-InfoCard | |||
| Monomer | Iodosobenzol-Monomer | ||
| Summenformel der Wiederholeinheit | C6H5IO | ||
| Molare Masse der Wiederholeinheit | 219,94 g·mol−1 | ||
| PubChem | 92125 | ||
| Kurzbeschreibung |
gelblich-grauweiße Flocken[1] | ||
| Eigenschaften | |||
| Aggregatzustand |
fest[1] | ||
| Kristallinität | |||
| Löslichkeit |
| ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Iodosobenzol ist eine chemische Verbindung und ein Polymer.
Gewinnung und Darstellung
Iodosobenzol kann durch basische Hydrolyse von Iodbenzoldichlorid[1] oder von Diacetoxyiodbenzol[4] gewonnen werden. Es kann auch durch Oxidation von Iodbenzol mit Ozon synthetisiert werden.[1]
Eigenschaften
Physikalische Eigenschaften
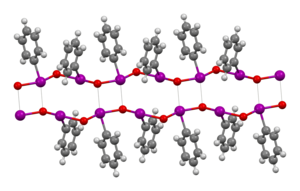
Man ging lange Zeit davon aus, Iodosobenzol sei amorph.[1] Wegeberg et al. fanden jedoch 2016 ein monoklines Kristallsystem mit der Raumgruppe P21/c. Die Gitterparameter bestimmten sie zu a=14,306(4) Å, b=5,868(1) Å, c=7,407(4) Å, α=90 °, β=101,04(3) °C, γ=90 °C. Die Autoren erklärten mit der doppelschichtigen Kristallstruktur die schlechte Löslichkeit in den meisten Lösungsmitteln.[2] Die Iod–Sauerstoff-Bindung ist im Gegensatz zu vielen früher gezeigten Elektronenformeln eine σ-Bindung, keine π-Bindung. Zudem geht man nach theoretischen Betrachtungen davon aus, dass im Monomer dementsprechend eine zwitterionische Iod–Sauerstoff-Bindung vorliegt, was der Oktettregel entspräche.[5] Dass üblicherweise jedoch eine polymere Form mit Iod-Sauerstoff-Ketten vorliegt, schlossen Hans Siebert und Monika Handrich schon 1976 aus Schwingungsspektren. Dieser Schluss kam zum einen dadurch zustande, dass I–O-Valenzschwingungen im selben Bereich auftraten wie bei Diiodpentoxid, in welchem ebenfalls I–O-Einfachbindungen vorliegen und zum anderen dadurch, dass nicht eine einzelne derartige I–O-Valenzschwingung, sondern zwei verschiedene beobachtet wurden. Die entsprechenden Banden liegen im Bereich 400–500 cm−1.[6]
Chemische Eigenschaften
Alkohole sind imstande das Iodosobenzol langsam zu Iodbenzol zu reduzieren. Dabei entstehen Aldehyde. Bei Erwärmen disproportioniert es zu Iodylbenzol[7] und Iodbenzol. Diese Mischung explodiert heftig bei 210 °C. Ameisensäure wird von Iodosobenzol zu Kohlenstoffdioxid oxidiert. Es reagiert außerdem heftig mit Anilin.[1]
Verwendung
Iodosobenzol wird in chemischen Synthesen als Sauerstoff-Transfer-Reagenz verwendet.[2] Typisch ist die Erzeugung von Nitriloxiden aus Nitrilen mittels diesen Reagenzes.[8]
Einzelnachweise
- ↑ a b c d e f g h C. Willgerodt: Die organischen Verbindungen mit mehrwertigem Iod. In: J. Schmidt (Hrsg.): Chemie in Einzeldarstellungen. Band 7. Verlag von Ferdinand Enke, Stuttgart 1914, S. 30–33.
- ↑ a b c C. Wegeberg, C. G. Frankær, C. J. McKenzie: Reduction of hypervalent iodine by coordination to iron(III) and the crystal structures of PhIO and PhIO2. In: Dalton Transactions. Band 45, Nr. 44, 2016, S. 17714–17722, doi:10.1039/C6DT02937J.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Saltzman, J. G. Sharefkin: IODOSOBENZENE. In: Organic Syntheses. Band 43, 1963, S. 60, doi:10.15227/orgsyn.043.0060.
- ↑ A. S. Ivanov, I. A. Popov, A. I. Boldyrev, V. V. Zhdankin: The I=X (X= O,N,C) Double Bond in Hypervalent Iodine Compounds: Is it Real? In: Angewandte Chemie International Edition. Band 126, Nr. 36, 2014, S. 9771–9775, doi:10.1002/anie.201405142.
- ↑ H. Siebert, M. Handrich: Schwingungsspektren und Struktur von Jodosyl-und Jodyl-Verbindungen. In: Zeitschrift für anorganische und allgemeine Chemie. Band 426, Nr. 2, 1976, S. 173–183, doi:10.1002/zaac.19764260206.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Iodylbenzol: CAS-Nummer: 696-33-3, ECHA-InfoCard: 100.220.923, GESTIS-Stoffdatenbank: 496329, PubChem: 101840, ChemSpider: 92012, Wikidata: Q83096903.
- ↑ N. Chatterjee, P. Pandit, S. Halder, A. Patra, D. K. Maiti: Generation of nitrile oxides under nanometer micelles built in neutral aqueous media: Synthesis of novel glycal-based chiral synthons and optically pure 2, 8-dioxabicyclo[4.4.0]decene core. In: The Journal of Organic Chemistry. Band 73, Nr. 19, 2008, S. 7775–7778, doi:10.1021/jo801337k.