Kernmasse
Die Kernmasse bezeichnet die Masse eines von allen Elektronen der Hülle befreiten nackten Atomkerns.
Sie unterscheidet sich von der Atommasse um die Massen der im Atom gebundenen Elektronen und das Massenäquivalent der Bindungsenergie aller Elektronen:
Es bedeuten
- die Ordnungszahl
- die Elektronenmasse
- die Lichtgeschwindigkeit.
Das Massenäquivalent der elektronischen Bindungsenergie
kann in Analogie zum nuklearen Massendefekt als elektronischer Massendefekt bezeichnet werden.
Die Bindungsenergie der Elektronenhülle kann experimentell nicht direkt bestimmt werden, stattdessen ist man auf theoretische Abschätzungen angewiesen. Die Berechnung nach dem Thomas-Fermi-Modell liefert für ein Atom mit Elektronen den Näherungswert
- (Formel 1).
Nach der Hartree-Fock-Slater-Methode berechnete Bindungsenergien für alle Elektronen des Atoms können Tabellen von 1976[1] entnommen werden. Eine weitere Zahlenwertgleichung, die die Bindungsenergie aller Elektronen eines Atoms besser approximiert als die Formel 1, ist in einem Zeitschriftenartikel aus dem Jahr 2003[2] angegeben:
- (Formel 2).
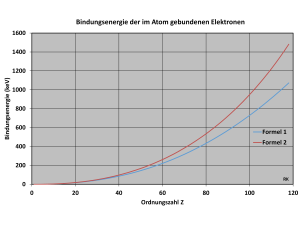
Die Abbildung zeigt die Kurvenverläufe für die Bindungsenergie der im Atom gebundenen Elektronen in Abhängigkeit von der Ordnungszahl für beide Formeln. Für Uran-Isotope 92U, also , ergibt sich eine totale elektronische Bindungsenergie nach Formel 1 von 600 keV bzw. nach Formel 2 von 763 keV. Zum Vergleich sei daran erinnert, dass das Energieäquivalent der Masse eines Elektrons 511 keV beträgt.
Die Genauigkeit der berechneten Werte für die Größe ist nicht bekannt. Vermutlich ist die Unsicherheit für Uran-Isotope in den Tabellen von 1976[1] kleiner als 2 keV.[3]
Bei praktischen Berechnungen (Kernmassen mit 6 bis 7 geltenden Ziffern im Fall leichter Nuklide) kann manchmal der elektronische Massendefekt vernachlässigt werden. Dann gilt die Näherung:
Kernmassen können in Massenspektrometern sehr genau bestimmt werden, wenn das entsprechende Atom vollständig ionisiert ist. Dies ist jedoch nur bei niedrigen Ordnungszahlen mit vertretbarem Aufwand möglich. Heutzutage gibt es einige Messungen der Masse von vollständig (also nackten Atomkernen) oder nahezu vollständig ionisierten Atomen.[3]
Atomkerne sind leichter als die Summe ihrer Bestandteile (Protonen- und Neutronenmassen):
Es bedeuten
- die Ordnungszahl
- die Masse eines Protons
- die Anzahl der Neutronen
- die Masse eines Neutrons.
Der nukleare Massendefekt
- ,
das Massenäquivalent der Bindungsenergie der Nukleonen des Atomkerns, ist um Größenordnungen größer als der elektronische Massendefekt.
Einzelnachweise
- ↑ a b Keh-Ning Huang et al.: Neutral-atom electron binding energies from relaxed-orbital relativistic Hartree-Fock-Slater calculations 2 ≤ Z ≤ 106. In: Atomic Data and Nuclear Data Tables. Band 18, Nr. 3, 1976, S. 243–291, doi:10.1016/0092-640X(76)90027-9.
- ↑ D. Lunney, J. M. Pearson, C. Thibault: Recent trends in the determination of nuclear masses. In: Rev. Mod. Phys. Band 75, 2003, S. 1021, doi:10.1103/RevModPhys.75.1021.
- ↑ a b Georges Audi: A Lecture on the Evaluation of Atomic Masses. 2004, S. 11 (31 S., in2p3.fr [PDF; abgerufen am 10. Januar 2017]).