Labionin
| Strukturformel | |||
|---|---|---|---|
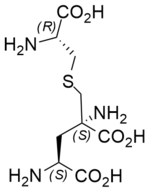
| |||
| Strukturformel von Labionin | |||
| Allgemeines | |||
| Name | Labionin | ||
| Andere Namen |
(4S)-4-Amino-2-[[[(2R)-2-amino-2-carboxyethyl]thio]methyl]-L-glutaminsäure | ||
| Summenformel | C9H17N3O6S | ||
| Externe Identifikatoren/Datenbanken | |||
| |||
| Eigenschaften | |||
| Molare Masse | 295,31 g·mol−1 | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Labionin ist eine nicht-kanonische Aminosäure die erstmals 2010 in dem Peptid Labyrinthopeptin A2 nachgewiesen wurde.[2] Diese Aminosäure zeichnet sich durch ihre komplexe Struktur aus, da sie eine Schwefelbrücke (hier: ein Thioether), in Analogie zu Lanthionin, und jeweils drei Amino- und Carbonsäuregruppen besitzt. Des Weiteren enthält Labionin drei Stereozentren mit der Konfiguration 2S,4S,8R, wobei es sich bei der Position 2 um ein quartäres Kohlenstoffatom handelt.[3] Die Natur formt Labionin aus zwei Serinen und einem Cystein, durch Dehydrierung der Serine, Addition der Thiolgruppe des Cystein an ein Dehydroalanin und anschließende Michael-Addition einer reaktiven Zwischenstufe an das verbliebene Dehydroalanin.[4] Darüber hinaus wurde Labionin bisher in Labyrinthopeptin A1[5], Erythreapeptin[6] und Catenulipeptin[7] und in dem Peptid NAI-112[8] nachgewiesen.
Für den Nachweis von Labionin bzw. eines Abbauproduktes diese Aminosäure in Peptiden ist eine GCMS-Methode beschrieben.[5]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Kathrin Meindl, Timo Schmiederer, Kathrin Schneider, Andreas Reicke, Diane Butz, Simone Keller, Hans Gühring, László Vértesy, Joachim Wink, Holger Hoffmann, Mark Brönstrup, George M. Sheldrick, Roderich Süssmuth: Labyrinthopeptins: A New Class of Carbacyclic Lantibiotics. In: Angewandte Chemie International Edition. 49, 2010, S. 1151, doi:10.1002/anie.200905773.
- ↑ Olga Genilloud, Francisca Vicente, David E. Thurston, Ana Martinez, David Rotella, Salvatore Guccione, Robin Ganellin: Drug Discovery from Natural Products. Royal Society of Chemistry, 2012, ISBN 978-1-84973-361-8, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wolfgang M. Müller, Timo Schmiederer, Paul Ensle, Roderich D. Süssmuth: In Vitro Biosynthesis of the Prepeptide of Type-III Lantibiotic Labyrinthopeptin A2 Including Formation of a C–C Bond as a Post-Translational Modification. In: Angewandte Chemie International Edition. 49, 2010, S. 2436, doi:10.1002/anie.200905909.
- ↑ a b Alexander Pesic, Maik Henkel, Roderich D. Süssmuth: Identification of the amino acid labionin and its desulfurised derivative in the type-III lantibiotic LabA2 by means of GC/MS. In: Chemical Communications. 47, 2011, S. 7401, doi:10.1039/C1CC11573A.
- ↑ Ginka H. Völler, Joanna M. Krawczyk, Alexander Pesic, Bartlomiej Krawczyk, Jonny Nachtigall, Roderich D. Süssmuth: Characterization of New Class III Lantibiotics-Erythreapeptin, Avermipeptin and Griseopeptin from Saccharopolyspora erythraea, Streptomyces avermitilis and Streptomyces griseus Demonstrates Stepwise N-Terminal Leader Processing. In: ChemBioChem. 13, 2012, S. 1174, doi:10.1002/cbic.201200118.
- ↑ H. Wang, W. A. van der Donk: Biosynthesis of the class III lantipeptide catenulipeptin. In: ACS Chem. Biol.. 7, 2012, S. 1529–1535, PMID 22725258 PMC 3448297 (freier Volltext).
- ↑ M. Iorio, O. Sasso, S. I. Maffioli, R. Bertorelli, P. Monciardini, M. Sosio, F. Bonezzi, M. Summa, C. Brunati, R. Bordoni, G. Corti, G. Tarozzo, D. Piomelli, A. Reggiani, S. Donadio: A glycosylated, labionin-containing lanthipeptide with marked antinociceptive activity. In: ACS Chem. Biol.. 9, 2014, S. 398–404, PMID 24191663.