Lithiumamid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
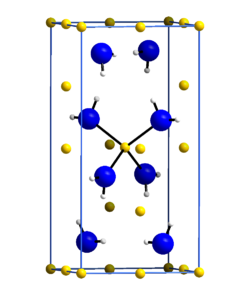
| |||||||||||||
| _ Li+ _ N3− _ H+ | |||||||||||||
| Kristallsystem | |||||||||||||
| Raumgruppe |
I4 (Nr. 82) | ||||||||||||
| Gitterparameter | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lithiumamid | ||||||||||||
| Verhältnisformel | LiNH2 | ||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 22,96 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,178 g·cm−3 (20 °C)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
430 °C[2] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Lithiumamid ist eine chemische Verbindung des Lithiums aus der Gruppe der Amide.
Gewinnung und Darstellung
Lithiumamid wird industriell durch Erhitzen von Lithium oder Lithiumhydrid in einem Strom von Ammoniak hergestellt. Außerdem bildet es sich langsam, wenn Lithium in flüssigem Ammoniak gelöst wird.[4] Wie auch bei anderen Alkali- und Erdalkaliamiden wird diese Reaktion durch die Anwesenheit von Eisen(II)-chlorid erheblich beschleunigt.[5]
Eigenschaften
Lithiumamid ist ein farb- und geruchloser Feststoff, der sich in Wasser zersetzt.[2]
Die Verbindung ist allgemein sehr hydrolyseempfindlich, kristallisiert tetragonal mit der Raumgruppe I4 (Nr. 82) und greift Glas schwach an.[3][6] Beim Erhitzen im Vakuum gibt sie oberhalb von 300 °C Ammoniak ab. Der quantitative Abbau zu Lithiumimid erfolgt jedoch erst bei 400 °C und erst oberhalb 750–800 °C zersetzt sie sich unter Abgabe von Stickstoff, Wasserstoff und Ammoniak.[6]
Verwendung
Lithiumamid wird in der organischen Chemie bei Claisen-Kondensationen, bei der Alkylierung von Nitrilen und Ketonen sowie der Synthese von Ethinyl-Verbindungen und Carbinolen verwendet.[4] Sie wird weiterhin als Reagenz zur Kreuzkupplung von Arylchloriden und Aminen eingesetzt.[7]
Einzelnachweise
- ↑ W.I.F. David, M.O. Jones, D.H. Gregory, C.M. Jewell, S.R. Johnson, A. Walton, P.P. Edwards: A mechanism for non-stoichiometry in the lithium amide/lithium imide hydrogen storage reaction. In: Journal of the American Chemical Society, 2007, 129(6), S. 1594–1601, doi:10.1021/ja066016s.
- ↑ a b c d e f g h Datenblatt Lithiumamid bei Merck, abgerufen am 27. März 2013.
- ↑ a b Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 536 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu LITHIUM AMIDE in der Hazardous Substances Data Bank, abgerufen am 28. März 2013 (online auf PubChem).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 666.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 448.
- ↑ Datenblatt Lithium amide, powder, 95% bei Sigma-Aldrich, abgerufen am 28. März 2013 (PDF).





