Lithiumiodid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
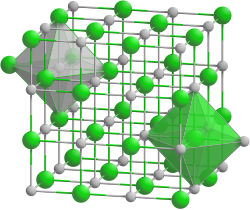
| |||||||||||||
| _ Li+ _ I− | |||||||||||||
| Kristallsystem |
kubisch | ||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||
| Koordinationszahlen |
Li[6], I[6] | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Lithiumiodid | ||||||||||||
| Andere Namen |
Lithiumjodid | ||||||||||||
| Verhältnisformel | LiI | ||||||||||||
| Kurzbeschreibung |
weißer, geruchsloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 133,85 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
3,49 g·cm−3 (25 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
1171 °C[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,955[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−270,08 kJ·mol−1[5] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Lithiumiodid, LiI, ist das Lithiumsalz der Iodwasserstoffsäure. Neben dem wasserfreien Lithiumiodid existieren noch verschiedene Hydrate, bekannt sind LiI·nH2O mit n= 0,5, 1, 2 und 3.[6]
Gewinnung und Darstellung
Die Herstellung von Lithiumiodid erfolgt durch Umsetzung wässriger Lithiumhydroxid- oder Lithiumcarbonatlösungen mit Iodwasserstoff und anschließender Aufkonzentrierung und Trocknung.[6]
Das wasserfreie Lithiumiodid kann auch durch Reaktion von Lithiumhydrid mit Iod in wasserfreiem Diethylether hergestellt werden.[7]
Eigenschaften
Lithiumiodid bildet farblose, stark hygroskopische Kristalle mit einem Schmelzpunkt von 446 °C, einem Siedepunkt von 1180 °C und einer Dichte von 3,49 g·cm−3. Die molare Masse des wasserfreien Lithiumiodids beträgt 133,85 g/mol. Durch die Oxidation von Iodid zu Iod durch Luftsauerstoff färben sich die Kristalle schnell gelblich bis bräunlich.[6]
Das Trihydrat weist einen Schmelzpunkt von 73 °C auf.[1] Beim Erhitzen verliert es bei 80 °C zwei Moleküle und bei 300 °C ein weiteres Molekül Kristallwasser.[8] Lithiumiodid ist gut in Wasser (1650 g/l Wasser bei 20 °C) und Ethanol löslich.
Die Standardbildungsenthalpie des kristallinen Lithiumiodids beträgt ΔfH0298 = −270,08 kJ/mol.[9]
Verwendung
Das wasserfreie Lithiumiodid wird für organische Synthesen verwendet[6], in den Batterien von Herzschrittmachern (Lithium-Iod-Batterien) dient es als Elektrolyt.[10][11] Dotierte Kristalle dienen als Szintillationsdetektor für langsame Neutronen.[12]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Lithiumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 14. (PDF)
- ↑ G. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and Properties. S. 370, Wiley-IEEE, 2005, ISBN 9780471736615.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- ↑ Eintrag zu lithium iodide (Condensed phase thermochemistry data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1151–1152.
- ↑ M. D.Taylor, L. R. Grant: New Preparations of Anhydrous Iodides of Groups I and II Metals, in: J. Am. Chem. Soc. 1955, 77, 1507–1508
- ↑ G. F. Hüttig, F. Pohle: Studien zur Chemie des Lithiums. II. Über die Hydrate des Lithiumjodids, in: Z. anorg. allg. Chem. 1924, 138, 1–12.
- ↑ Oliver Herzberg: Untersuchung organischer Festkörperreaktionen am Beispiel von Substitutions- und Polykondensationsreaktionen, Dissertation, Universität Hamburg 2000. DNB 960245774/34
- ↑ L. F. Trueb, P. Rüetschi: Batterien und Akkumulatoren - Mobile Energiequellen für heute und morgen., Springer, Berlin 1998 ISBN 3-540-62997-1.
- ↑ The Lithium/Iodine-Polyvinylpyridine Pacemaker Battery - 35 years of Successful Clinical Use: The Lithium/Iodine-Polyvinylpyridine Pacemaker Battery - 35 years of Successful Clinical Use. Hrsg.: C. Holmes. doi:10.1149/1.2790382.
- ↑ K. P. Nicholson: Some lithium iodide phosphors for slow neutron detection, in: J. Appl. Phys. 1955, 6, 104–106.



