Lithiumorganische Verbindungen
Als lithiumorganische Verbindungen, auch Organolithium-Verbindungen oder Lithiumorganyle, bezeichnet man organische Verbindungen, die eine direkte Bindung zwischen Kohlenstoff und Lithium besitzen.
Herstellung
Die Synthese von Lithiumorganylen wird als Lithiierung bezeichnet. Es sind mehrere etablierte Wege zur Synthese von Organolithium-Verbindungen bekannt.
Aus Halogeniden
Alkyl- und Aryllithium-Verbindungen können durch Umsetzung der entsprechenden Halogenide mit elementarem Lithium erhalten werden:[1]
- R = Organischer Rest, X = Halogenid.
Als Halogenide eignen sich Chlorid, Bromid und Iodid. Hierbei läuft jedoch die Wurtz-Reaktion als Nebenreaktion ab.
- Wurtz-Reaktion
An Stelle elementaren Lithiums können auch kommerziell erhältliche Organolithium-Verbindungen als Lithiierungsreagenzien eingesetzt werden. Diese gehen mit Organohalogeniden eine Metathesereaktion ein, wobei die lithiierte Verbindung und das entsprechende Alkylhalogenid gebildet werden.
- Lithiierung eines Aromaten, Ar = Aryl, X = Halogenid.
Aus der Spaltung von C-H-Bindungen
Ein weiterer Weg zur Lithiierung ist die Deprotonierung der zur lithiierenden Substanz mit kommerziell erhältlichen Organolithiumverbindungen, beispielsweise n-Butyllithium. Hierbei wird ein aktiviertes Proton durch das Lithiumorganyl abstrahiert, wodurch sich das gewünschte Lithiumorganyl bildet und das dem eingesetzten Lithiumorganyl zu Grunde liegende Alkan freigesetzt wird.
Diese Reaktion erfordert jedoch, dass das gebildete Lithiumorganyl schwächer basisch ist als das ursprüngliche. Da das eingesetzte Lithiumorganyl stark basisch ist und infolgedessen mit geringer Selektivität reagiert, muss das zu abstrahierende Proton deutlich saurer sein als weitere im Molekül vorhandene Protonen.
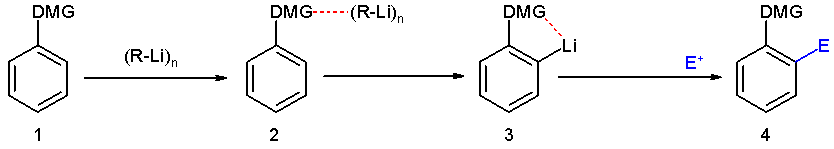
Eine definierte Lithiierung von Aromaten kann beispielsweise durch ortho-dirigierende-Gruppen erzielt werden. Zu den ortho-dirigierenden Gruppen gehören beispielsweise tertiäre Amine, Amide oder die Methoxygruppe. Diese besitzen freie Elektronenpaare, die das Lithiumion stabilisieren und somit in räumliche Nähe zu dem ortho-ständigen Proton bringen, das dann bevorzugt abstrahiert werden kann.
Dieser Effekt ist ähnlich der ortho-Selektivität, die in der Kolbe-Schmitt-Reaktion zur Synthese von Salicylsäure ausgenutzt wird.
Eigenschaften
Auf Grund der hohen Elektronegativitätsdifferenz zwischen Lithium (0,98) und Kohlenstoff (2,55) besitzt die Lithium-Kohlenstoff-Bindung einen stark ionischen Charakter. Das gemessene Dipolmoment beträgt 6 D. Bei einer rein ionischen Bindung würde jedoch ein Dipolmoment von 9,5 D erwartet, was den partiell kovalenten Charakter der Bindung zeigt. Die Bindung ist stark polar, wobei dem Kohlenstoffatom die negative Ladung zukommt und es carbanionische Eigenschaften besitzt. Der ionische Anteil an der Bindung ist jedoch in den meisten Fällen geringer als der kovalente, sodass Lithiumorganyle korrekterweise nicht als Kontaktionenpaar dargestellt werden.
In Lösung liegen viele Lithiumorganyle nicht monomer vor, sondern aggregieren zu geordneten Strukturen. Dies ist auf die koordinative Untersättigung des Lithiums in einer 2-Elektron-2-Zentren-Bindung zurückzuführen. Aus diesem Grund bilden Organolithium-Verbindungen oft Oligomere, um eine koordinative Sättigung zu erreichen. So bildet n-Butyllithium in Diethylether tetramere und in Cyclohexan hexamere Strukturen aus. Strukturell stellt sich das Tetramer als Lithiumtetraeder dar, auf dessen Flächen die Alkylreste gebunden sind.
Alle Lithiumorganischen Verbindungen sind starke Basen, die mit Wasser und anderen protischen Lösungsmitteln teils sehr heftig reagieren.
- Reaktion von Butyllithium mit Wasser unter Bildung von Butan und Lithiumhydroxid.
Einige Verbindungen, wie beispielsweise tert-Butyllithium, sind pyrophor.
Verwendung
Zur Synthese von Komplexen
Lithium ist ein unedles Metall, weshalb gebundene Reste auf edlere Metalle transmetalliert werden können. Diese Eigenschaft macht man sich beispielsweise bei der Herstellung von Schrock-Carbenen zu Nutze. Die Reste werden im Sinne einer Substitutionsreaktion auf das edlere, mit labilen Liganden komplexierte Metallion transmetalliert, wobei ein Lithiumsalz als Nebenprodukt anfällt.

Auch zur Synthese von Gilman-Cupraten werden Lithiumorganyle verwendet.
Als Nukleophil
Der carbanionische Charakter des Kohlenstoffatoms in Lithiumorganylen ermöglicht diesem als Nukleophil zu agieren. Sie können zu Additionsreaktionen an Elektrophilen eingesetzt werden. So addieren sich Lithiumorganyle an Ketone und Aldehyde und gehen Substitutionsreaktionen mit Estern ein.
Aromatische Lithiumverbindungen eignen sich zur Einführung einer ganzen Reihe von Substituenten am aromatischen System. Die Reichweite dieser Reaktion beginnt bei einfachen Alkylierungen, bei welchen meist mit einem Alkylhalogenid umgesetzt wird. Auch Bromierungen, Iodierungen und Carboxylierungen sind auf diesem Wege möglich. Auch Boronsäureester, wie sie zur Suzuki-Kupplung benötigt werden, sowie Zinnorganische Verbindungen, die zur Stille-Kupplung eingesetzt werden können, sind durch Umsetzung des Lithiumorganyls mit den entsprechenden Chloriden zugänglich.
Literatur
- C. Elschenbroich: Organometallchemie, 6. Auflage, Vieweg+Teubner Verlag, 2008, ISBN 3-8351-0167-6.
- A. Salzer: Organometallic compounds, in: Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH Weinheim.
Einzelnachweise
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 543–545, ISBN 3-342-00280-8.