Magnesiumwolframat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
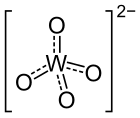
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Magnesiumwolframat | ||||||||||||
| Andere Namen |
Magnesiumwolframoxid | ||||||||||||
| Summenformel | MgWO4 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 272,14 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Magnesiumwolframat ist eine anorganische chemische Verbindung des Magnesiums aus der Gruppe der Wolframate.
Vorkommen
Magnesiumwolframat kommt natürlich in Form des rötlich braunen Minerals Huanzalait vor.[4]
Gewinnung und Darstellung
Magnesiumwolframat kann durch Reaktion von Magnesiumoxid mit Wolframtrioxid und von einem Magnesiumsalz, z. B.: Magnesiumnitrat und Natriumwolframat gewonnen werden.[5]
Eigenschaften
Magnesiumwolframat ist ein weißer Feststoff, der praktisch unlöslich in Wasser ist.[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P2/c (Raumgruppen-Nr. 13). Es existiert noch ein Hochtemperaturform oberhalb von 1065 °C.[6] Das Dihydrat hat eine Kristallstruktur mit der Raumgruppe P21/c (Nr. 14) und setzt sich bei 650 °C in das Anhydrat um.[7][8]
Verwendung
Magnesiumwolframat wird als Leuchtstoff verwendet.[9][10]
Einzelnachweise
- ↑ a b c Datenblatt Magnesiumwolframat bei AlfaAesar, abgerufen am 11. Juni 2016 (PDF) (JavaScript erforderlich).
- ↑ a b c Datenblatt Magnesium wolframat, −325 mesh, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 11. Juni 2016 (PDF).
- ↑ Allen Alper: High Temperature Oxides. Elsevier, 2012, ISBN 978-0-323-15834-3, S. 116 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ mineralienatlas.de: Mineralienatlas Lexikon - Huanzalait, abgerufen am 11. Juni 2016
- ↑ J. Ruiz-Fuertes, D. Errandonea, S. López-Moreno, J. González, O. Gomis, R. Vilaplana, F. J. Manjón, A. Muñoz, P. Rodríguez-Hernández, A. Friedrich, I. A. Tupitsyna, L. L. Nagornaya: High-pressure Raman spectroscopy and lattice-dynamics calculations on scintillating MgWO4: Comparison with isomorphic compounds. In: Physical Review B. 83, 2011, doi:10.1103/PhysRevB.83.214112.
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 845 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ John R. Günter, Erich Dubler: Crystal structure and topotactic dehydration of magnesium tungstate dihydrate, MgWO4 - 2H2O. In: Journal of Solid State Chemistry. 65, 1986, S. 118, doi:10.1016/0022-4596(86)90096-4.
- ↑ M. Amberg, J.R. Günter, H. Schmalle, G. Blasse: Preparation, crystal structure, and luminescence of magnesium molybdate and tungstate monohydrates, MgMoO4 - H2O and MgWO4 - H2O. In: Journal of Solid State Chemistry. 77, 1988, S. 162, doi:10.1016/0022-4596(88)90104-1.
- ↑ Gunter Buxbaum: Industrial Inorganic Pigments. John Wiley & Sons, 2008, ISBN 3-527-61210-6, S. 249 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Blasse, B.C. Grabmaier: Luminescent Materials. Springer Science & Business Media, 2012, ISBN 978-3-642-79017-1, S. 112 (eingeschränkte Vorschau in der Google-Buchsuche).

