Sulfonamide

Sulfonamide (chemisch genauer Sulfanilamide) sind eine Gruppe synthetischer chemischer Verbindungen mit antimikrobieller Wirkung. Manche Vertreter werden daher als Antibiotika eingesetzt. Ihre Wirkung beruht darauf, dass sie die Bakterien an der Herstellung von Folsäure hindern, die für die Herstellung von Nukleotiden, den Grundbausteinen der Erbsubstanz, nötig ist. Bakterien werden dadurch nicht direkt getötet, sondern an der Vermehrung gehindert, da sie ihre Erbinformation nicht kopieren können. Strukturell handelt es sich bei den Sulfonamiden um Abkömmlinge des 4-Aminobenzolsulfonsäureamids; sie gehören damit zur großen Gruppe der Sulfonsäureamide, die durch die Gruppe –SO2NHR– charakterisiert ist. Aus den Anfängen der chemisch-synthetischen Herstellung antimikrobieller Substanzen stammt die ebenfalls für solche Wirkstoffe noch verwendete Bezeichnung Chemotherapeutikum.
Mit den Sulfonamiden strukturell verwandte Substanzen sind die Sulfonylharnstoffe, die als orale Antidiabetika verwendet werden, und die Thiaziddiuretika.
Die Wirkung der Sulfonamide als antimikrobielle Agenzien zur Behandlung von Infektionskrankheiten beruht darauf, dass sie als Antimetabolite der p-Aminobenzoesäure (PABA) wirken. Sie hemmen kompetitiv die Dihydropteroat-Synthase des Stoffwechselweges der Folsäure-Synthese von Bakterien, welche die Dihydropteroinsäure-Bildung katalysiert. Eukaryotische (und damit auch menschliche) Zellen werden hiervon nicht beeinträchtigt, da diese keine Folsäure erzeugen. Die Wirksamkeit beruht auch auf der strukturellen Ähnlichkeit der Sulfonamide mit Carbonsäureamiden, wobei deren Carbonylgruppe durch eine Sulfonylgruppe ersetzt ist; sie sind also Analoga von Amiden. Typische Vertreter sind Sulfamethoxazol, das länger wirksame Sulfadoxin, das Sulfacarbamid mit kürzerer Wirkdauer oder Sulfasalazin, das im Darm nicht aufgenommen wird. Sulfanilsäure selbst hat keinen nennenswerten Effekt gegen Bakterien, da sie die Membran der Mikroorganismen wegen ihrer hohen Polarität kaum durchdringen kann.[1]
Herstellung
Für die Herstellung der Sulfonamide sind unterschiedliche Synthesen entwickelt worden. Entscheidend für die gewählte Art der Synthese ist die Verfügbarkeit der Ausgangschemikalien und ein einfacher und problemloser Verlauf der Zwischenschritte. Elektrochemische Synthesekonzepte eröffnen Reaktionswege, die teils eine direkte Einführung der Sulfonamid-Gruppe bei weniger drastischen Bedingungen ermöglichen.[2]
Nachfolgend sind als Beispiel für die Herstellung von Sulfonamiden zwei mögliche Synthesen für Sulfapyridin dargestellt.
- Kondensation von p-Acetamino-benzol-sulfochlorid mit einem Amin und anschließende Hydrolyse der Acetylgruppe:[3]
oder als zweite Möglichkeit:
- Kondensation von p-Nitrobenzolsulfonsäurechlorid mit einem Amin und anschließende Reduktion der Nitrogruppe:[4]
Geschichte
Entwicklung synthetischer Antibiotika
Mit der wissenschaftlichen Erforschung und der Synthese von organischen Verbindungen im 19. Jahrhundert begann auch die Suche nach Verbindungen mit antibakteriellen Eigenschaften. Versuche, Bakterien (unmittelbar) abzutöten erfolgten (etwa in der Zeit zwischen 1865 und 1918) zunächst mit Phenol (als „Carbolspray“) und Chininderivaten (wie Vuzin) und Rivanol.[5] Paul Ehrlich gehörte zu den ersten Chemikern, die systematisch chemische Verbindungen auf ihre Wirkung auf Bakterien untersuchten. Ehrlichs Arbeitsschwerpunkt lag dabei auf Azofarbstoffen und ähnlichen Verbindungen. Nach Untersuchungen mit dem Azofarbstoff Trypanrot und der arsenhaltigen Verbindung Atoxyl vermutete er, dass Strukturen mit Azogruppen (-N=N-) wie auch arsenorganische Verbindungen (-As=As-) besonders geeignet seien.[6] In seinem Labor wurden deshalb viele neue arsenhaltige Verbindungen synthetisiert und überprüft.
Für das 1909 in seinem Labor entwickelte Salvarsan konnte Ehrlich zusammen mit dem japanischen Bakteriologen Sahachiro Hata bis 1910[7] die antibakterielle Wirkung gegenüber Spirochäten und Trypanosomen nachweisen. Mit Salvarsan war erstmals eine ursächliche Behandlung und Heilung der Syphilis bei vertretbaren toxischen Nebenwirkungen möglich. Das in Deutschland entwickelte Salvarsan wurde patentiert und als einer der ersten vollsynthetischen Arzneistoffe bekannt. Das Patent wurde im Ersten Weltkrieg von den USA beschlagnahmt und die Verbindung unter dem Namen Arsphenamin weiter verwendet.[8]
Bereits 1908[3] hatte Paul Gelmo mit Sulfanilamid den ersten Vertreter aus der Stoffgruppe der Sulfonamide entwickelt. Heinrich Hörlein, der Sulfonamide mit Azostruktur (-N=N-) bereits als Textilfarbstoffe verwendet hatte,[9] war die treibende Kraft hinter einem Forschungsprogramm der I. G. Farben zur systematischen Entwicklung von antibakteriell wirksamen Verbindungen aus der Gruppe der Farbstoffe aus der Steinkohlenteer-Chemie nach dem Vorbild von Ehrlichs Salvarsan.
1932 synthetisierten die Chemiker Fritz Mietzsch und Josef Klarer innerhalb dieses Programms ein Sulfonamid, das später unter dem Markennamen Prontosil bekannt wurde. Dessen antibakterielle Wirkung wurde von dem Mediziner Gerhard Domagk kurz darauf (im Dezember 1932) entdeckt, der für die I.G. Farben im Bayer-Stammwerk in Wuppertal (Elberfeld) an der medizinischen Wirkung von Azofarbstoffen forschte und mit seinem Labor für experimentelle Pathologie in Elberfeld eng mit den Chemikern zusammenarbeitete. Außerhalb des lebenden Organismus (in vitro) zeigte sich das zunächst synthetisierte KL 695 weitgehend unwirksam gegen Streptokokken, wohl aber in vivo in Mäusen (KL 695 ging später nicht in klinische Tests). Das gleiche traf für die kurz darauf synthetisierte und getestete Variante Kl 730 zu, später Streptozon[10][11] und schließlich Prontosil genannt. Insbesondere der Nachweis der Wirkung im Tiermodell war das Verdienst von Domagk, der auch seine an einer Sepsis erkrankte vierjährige Tochter im Dezember 1933 erfolgreich mit dem neuen Arzneimittel behandelte.[12] Die Entwicklung wurde zunächst so weit wie möglich geheimgehalten,[13] aber noch Weihnachten 1932 wurde ein Patent beantragt (publiziert erst im Januar 1935).
Erst im Februar 1935[14] veröffentlichte Domagk seine Untersuchungen über die medizinische Wirksamkeit von Prontosil und damit erstmals eine Beschreibung der chemotherapeutischen Wirkung von Sulfonamiden. 1939 wurde Domagk für sein Werk der Nobelpreis verliehen, den er jedoch wegen der Gesetze zur Zeit des Nationalsozialismus nicht annehmen durfte.[15] Ein Grund der Verzögerung der Entwicklung war die Gegnerschaft der 1933 an die Macht gekommenen Nationalsozialisten zu Tierversuchen.[16]
Der Wirkungsmechanismus von Prontosil wurde 1935[3] von Jacques Tréfouël, Thérèse Tréfouël, Federico Nitti und Daniel Bovet im Laboratorium von Ernest Fourneau aufgeklärt:[17] Prontosil wird erst im Organismus zur pharmakologisch wirksamen Form, dem Sulfanilamid, verstoffwechselt, was seine Wirkungslosigkeit in vitro erklärt. Später gab es einen Streit darüber, ob auch die Bayer-Wissenschaftler die Bedeutung des Sulfanilamid-Bestandteils für die antibakterielle Wirkung erkannt hatten. Bovet vertrat die Ansicht, dass sie erst durch die Arbeit der französischen Wissenschaftler vom Pasteur-Institut darauf kamen, da sie an einen Zusammenhang von Farbstoffeigenschaften und antibakterieller Wirkung glaubten. Erst 1936 begann die Erprobung in bakteriologischen Laboratorien, klinische Tests bei IG Farben begannen erst im März 1936 und später im Jahr 1936 kam es als Prontosil Album (album für farblos) auf den Markt.[18] Der britische Bakteriologe Ronald Hare vertrat 1970 dagegen die Auffassung dass dies schon vorher den Bayer-Wissenschaftlern bekannt war, sie aber nach einer Komponente suchten, die patentierbar war.[19]
Mit den Sulfonamiden waren die ersten Breitspektrumantibiotika verfügbar, die in der Medizin mit Erfolg verwendet wurden. Erst später im Zweiten Weltkrieg ab 1940[20] wurde von Florey und Dunn das Penicillin ebenfalls in die medizinische Therapie eingeführt.[21]
Bis Ende der 1930er-Jahre wurden über 1000[3] sulfonamidische Verbindungen synthetisiert. Allerdings sind davon nur wenige pharmakologisch wirksam. Alle bisher geprüften kernsubstituierten Derivate des Sulfanilamids sind völlig unwirksam.[3] Besonders wirksam sind hingegen Verbindungen, die die Struktur:
enthalten.[3]
Verbreitete Anwendung fanden die Sulfonamide (in Klammern Angabe des Einführungsjahres) Sulfapyridin (1938), Sulfathiazol (1940), Sulfaguanidin (1940), Sulfadiazin (synonym: Sulfapyrimidin, 1941), Phthalylsulfathiazol (1942) sowie Mono- und Dimethyl-Derivate des Sulfathiazins (1943).[4]
Das erste Medikament mit einem Sulfonamid-Wirkstoff war Prontosil (Sulfamidochrysoidin). Sieht man von Prontosil ab, so sind die meisten Sulfonamide sowohl in vitro als auch in vivo wirksam.[22] Der antibakterielle Wirkmechanismus der Sulfonamide als Antimetabolite wurde 1940 von Donald D. Woods und Paul Fildes aufgeklärt.
Im Laufe der verbreiteten Anwendung der Sulfonamide in der antimikrobiellen Therapie entdeckte man bei einigen Vertretern weitere Wirkungen, was die Entwicklung weiterer Wirkstoffklassen begründete. So führte in den 1940er Jahren die Entdeckung der harntreibenden (diuretischen) Wirkung insbesondere des Sulfonamids Sulfanilamid zur Entwicklung der neuen Wirkstoffgruppe der „Thiaziddiuretika“. Bekannt wurde auch das namentlich die Harnflut (reflektorische Polyurie[23]) anregende Präparat Haflutan (6-Chlor-Benzol-1,3-disulfonamid). Wegen seiner blutzuckersenkenden Wirkung kam 1956 als erster Vertreter der in der antidiabetischen Therapie eingesetzten „Sulfonylharnstoffe“ das Sulfonamid Carbutamid auf den Markt.[24]
Penicillin und die diversen weiteren Verbindungen dieses Typs haben inzwischen weitgehend die Sulfonamide bei der medizinischen Verwendung abgelöst, da sie bei geringerer Dosierung sicherer wirken.[25] Zu den wenigen im Bereich der Medizin für Menschen auch in heutiger Zeit[26] noch verwendeten Sulfonamiden gehören die Verbindungen Sulfamethoxazol, Silbersulfadiazin und Sulfamerazin. In der Tiermedizin, besonders für die Behandlung von Erkrankungen durch Parasitenbefall, werden dagegen noch vielfach Kombinationspräparate mit Sulfonamiden verwendet.
Versuche zur Zeit des Nationalsozialismus
Zur Zeit des Nationalsozialismus fanden medizinische Experimente an KZ-Häftlingen in den Lagern KZ Ravensbrück und KZ Dachau statt. Hintergrund war, dass Reinhard Heydrich an Sepsis starb, während er unter der Aufsicht von Himmlers Leibarzt Karl Gebhardt stand. Hitlers Leibarzt Morell hatte kritisiert, Heydrich hätte möglicherweise überlebt, hätte man das Sulfonamid Ultraseptyl eingesetzt. Bei Heydrich wurden aber andere Sulfonamide verabreicht, Gebhardt kam in Bedrängnis und veranlasste die Experimente. KZ-Häftlingen wurden Verletzungen beigefügt und Wunden infiziert, um eine Sepsis zu erreichen und die Wirkweise verschiedener Sulfonamide testen zu können.[27] Gebhardt wurde unter anderem für diese Versuche im Nürnberger Ärzteprozess zum Tode verurteilt.
Tabelle Sulfonamide
Die nachfolgende Tabelle zeigt einen Überblick über die ersten einfacheren Verbindungen und die noch heute aktuellen Sulfonamide. Man rechnet auch Mafenid den Sulfonamiden zu, obwohl es keine Sulfanilamid-Struktur aufweist. Darüber hinaus wurden und werden aber auch noch weitere hier nicht aufgelistete Vertreter dieser Wirkstoffklasse in der Medizin verwendet. Als Antibiotika werden überwiegend Gemische aus 2 oder mehreren Sulfonamiden oder auch anderen Wirksubstanzen eingesetzt. Von fast allen einzelnen Verbindungen sind für die Namen sehr viele Synonyme – zum Teil weit über 20 – gebräuchlich.
| Struktur | INN-Name | CAS-Nr. PubChem |
Summenformel | IUPAC-Name | Verwendung[28] |
|---|---|---|---|---|---|
| Sulfanilamid | 63-74-1 5333 |
C6H8N2O2S | 4-Aminobenzensulfonamid | Grundbaustein der Sulfonamide | |
| Sulfathioharnstoff (Synonym: Sulfathiocarbamid[29]) | 515-49-1 3000579 |
C7H9N3O2S2 | (4-Aminophenyl)sulfonylthioharnstoff | kaum noch verwendet (Badional) | |
| Sulfacarbamid | 547-44-4 11033 |
C7H9N3O3S2 | (4-Aminophenyl)sulfonylharnstoff | in der Humanmedizin (Euvernil) | |
| Mafenid | 138-39-6 3998 |
C7H10N2O2S | 4-(Aminomethyl)benzensulfonamid | in der Tiermedizin und Humanmedizin (Verbrennungen) | |
| Sulfaguanidin | 57-67-0 5324 |
C7H10N4O2S | 4-Amino-N-(diaminomethylen)benzensulfonamid | in der Tiermedizin (selten angewendet) | |

|
Sulfacetamid | 144-80-9 5320 |
C8H10N2O3S | N-[(4-aminophenyl)sulfonyl]acetamid | in der Humanmedizin (Augen) |

|
Sulfathiazol | 72-14-0 5340 |
C9H9N3O2S2 | 4-Amino-N-(1,3-thiazol-2-yl)benzensulfonamid | in der Tiermedizin |
| Sulfamethizol | 144-82-1 5328 |
C9H10N4O2S2 | 4-Amino-N-(5-methyl-1,3,4-thiadiazol-2-yl)benzensulfonamid | in der Tiermedizin | |

|
Sulfametrol | 32909-92-5 64939 |
C9H10N4O3S2 | 4-Amino-N-(4-methoxy-1,2,5-thiadiazol-3-yl)benzensulfonamid | in Humanmedizin[30] |

|
Sulfamethylthiazol | 515-59-3 5328 |
C10H11N3O2S2 | 4-Amino-N-(4-methyl-1,3-thiazol-2-yl)benzensulfonamid | in der Humanmedizin |
| Sulfachlorpyridazin | 80-32-0 6634 |
C10H9ClN4O2S | 4-Amino-N-(6-chlorpyridazin-3-yl)benzensulfonamid | in der Tiermedizin | |
| Sulfachlorpyrazin | 1672-91-9 164867 |
C10H9ClN4O2S | 4-Amino-N-(5-chlorpyrazin-2-yl)benzensulfonamid | in der Tiermedizin für Geflügel | |

|
Sulfadiazin | 68-35-9 5215 |
C10H10N4O2S | 4-Amino-N-pyrimidin-2-ylbenzensulfonamid | in der Human- (Haut) und Tiermedizin |
| Sulfamethoxazol | 723-46-6 5329 |
C10H11N3O3S | 4-Amino-N-(5-methyl-1,2-oxazol-3-yl)benzensulfonamid | in der Human- und Tiermedizin | |

|
Sulfapyridin | 144-83-2 5336 |
C11H11N3O2S | 4-Amino-N-pyridin-2-yl-benzensulfonamid | in der Humanmedizin (Haut) |
| Sulfamerazin | 127-79-7 5325 |
C11H12N4O2S | 4-Amino-N-(4-methylpyrimidin-2-yl)benzensulfonamid | in der Tiermedizin[31] | |
| Sulfaperin | 599-88-2 68933 |
C11H12N4O2S | 4-Amino-N-(5-methylpyrimidin-2-yl)benzensulfonamid | nicht mehr angewendet | |
| Sulfamethoxypyridazin | 80-35-3 5330 |
C11H12N4O3S | 4-Amino-N-(6-methoxypyridazin-3-yl)benzensulfonamid | in der Tiermedizin | |
| Sulfamethoxydiazin | 651-06-9 5326 |
C11H12N4O3S | 4-Amino-N-(5-methoxypyrimidin-2-yl)benzensulfonamid | in der Humanmedizin | |
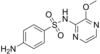
|
Sulfalen | 152-47-6 9047 |
C11H12N4O3S | 4-Amino-N-(3-methoxypyrazin-2-yl)benzensulfonamid | in der Tier- und Humanmedizin |
| Sulfamoxol | 729-99-7 12894 |
C11H13N3O3S | 4-Amino-N-(4,5-dimethyl-1,3-oxazol-2-yl)benzensulfonamid | in der Humanmedizin[32] | |

|
Sulfafurazol (Synonym: Sulfisoxazol[33]) | 127-69-5 5344 |
C11H13N3O3S | 4-Amino-N-(3,4-dimethyl-1,2-oxazol-5-yl)benzensulfonamid | in der Humanmedizin[34] |
| Sulfadicramid | 115-68-4 8281 |
C11H14N2O3S | N-(4-Aminophenyl)sulfonyl-3-methylbut-2-enamid | in der Humanmedizin (kaum noch verwendet) | |

|
Sulfadimidin | 57-68-1 5327 |
C12H14N4O2S | 4-Amino-N-(4,6-dimethylpyrimidin-2-yl)benzensulfonamid | in der Tiermedizin |

|
Sulfisomidin | 515-64-0 5343 |
C12H14N4O2S | 4-Amino-N-(2,6-dimethylpyrimidin-4-yl)benzensulfonamid | in der Humanmedizin[35] |

|
Sulfametomidin | 3772-76-7 19596 |
C12H14N4O3S | 4-Amino-N-(6-methoxy-2-methylpyrimidin-4-yl)benzensulfonamid | in der Humanmedizin |

|
Sulfadimethoxin | 122-11-2 5323 |
C12H14N4O4S | 4-Amino-N-(2,6-dimethoxypyrimidin-4-yl)benzensulfonamid | noch in der Tiermedizin. früherer Handelsname Madribon |
| Sulfadoxin | 2447-57-6 17134 |
C12H14N4O4S | 4-Amino-N-(5,6-dimethoxypyrimidin-4-yl)benzensulfonamid | in der Tiermedizin | |

|
Sulfaphenazol | 526-08-9 5335 |
C15H14N4O2S | 4-Amino-N-(1-phenyl-1H-pyrazol-5-yl)benzensulfonamid | in der Tiermedizin |

|
Sulfasalazin | 599-79-1 5359476 |
C18H14N4O5S | 2-Hydroxy-5-[(E)-4-(pyridin-2-ylsulfamoyl)phenyldiazenyl]benzoesäure | in der Human- und Tiermedizin |
Eigenschaften
Sulfonamide wirken bakteriostatisch. Werden sie einzeln eingesetzt, bilden sich schnell Resistenzen. Daher kombiniert man sie bevorzugt mit Dihydrofolsäurereduktase-Hemmern wie Trimethoprim (Cotrimoxazol s. u.). Sulfonamide sind relativ hydrophil, können oral (z. B. als Tablette) gegeben werden und werden mit unterschiedlichen Halbwertszeiten überwiegend über die Nieren ausgeschieden. Den Prozess der Sezernierung in den Nierentubuli teilen sie mit einigen anderen Säuren, die sich dann gegenseitig in ihrer Ausscheidung behindern: Harnsäure, Urikosurika und Urikostatika, Acetylsalicylsäure, Thiaziddiuretika, Penicillin und Makrolide. Der Ausscheidungsweg hat außerdem zur Folge, dass sie sich im harnableitenden System anreichern, was auch ihren wesentlichen Anwendungsbereich darstellt.
Anwendung
Sulfonamide werden oral oder intravenös verabreicht oder direkt auf Wunden aufgebracht. Sie wirken gegen Darmbakterien, zum Beispiel Escherichia coli, Pseudomonas, Salmonella, Shigella. Sie wirken außerdem gegen Staphylococcus, Streptococcus, Neisseria, Pneumocystis jirovecii, Toxoplasma gondii, Neospora caninum und Plasmodien. Sie werden hauptsächlich als Cotrimoxazol gegen unkomplizierte Harnwegsinfektionen eingesetzt und gegen Pneumonie durch Pneumocystis jirovecii (früher: P. carinii), hier als einziges Medikament. Ferner werden sie in diversen Kombinationen gegen therapiebedürftige Toxoplasmose oder Malaria eingesetzt. Gegen Bacteroides, Enterococcus,[36] Mykoplasmen, Pilze, Pseudomonas aeruginosa, die meisten Protozoen, Rickettsien und Viren sind Sulfonamide allerdings wirkungslos.[37]
In der Veterinärmedizin sind Sulfonamide gängige Antibiotika, die bei Atemwegs-, Magen-Darm- und Harnwegserkrankungen eingesetzt werden. Des Weiteren sind sie oft Mittel der Wahl bei der Behandlung von Nagetieren, da diese im Allgemeinen eine breite Unverträglichkeit auf Antibiotika (insbesondere Penicillin) aufweisen. Im Geflügelbereich waren Sulfonamide über lange Zeit das Mittel zur Bekämpfung von Kokzidien.
Sulfonamide werden meist in Kombination mit Diaminopyrimidinen eingesetzt. Eine fixe Kombination der Stoffe Sulfamethoxazol plus Trimethoprim im Verhältnis 5 zu 1 heißt Cotrimoxazol. Die Kombination soll der Entstehung von Antibiotikaresistenzen vorbeugen, außerdem potenziert sich die Wirkstärke von Antibiotika, die den gleichen Stoffwechselweg an unterschiedlicher Stelle blockieren. Für die Monotherapie wird in Deutschland nur noch Sulfadiazin eingesetzt zur Behandlung der akuten und rezidivierenden Toxoplasmose.
Rechtliche Bestimmungen
Die Gruppe der Sulfonamide ist in der Tabelle 1 der Verordnung (EU) Nr. 37/2010 über pharmakologisch wirksame Stoffe und ihre Einstufung hinsichtlich der Rückstandshöchstmengen in Lebensmitteln tierischen Ursprungs zusammengefasst und darf als solche nur in bestimmten Höchstmengen in verschiedenen tierischen Lebensmitteln vorkommen.[38] In der nachfolgenden Tabelle sind die rechtlichen Vorgaben zusammengefasst.
| Pharmakologisch wirksame(r) Stoff(e) | Markerrückstand | Tierart(en) | Rückstandshöchstmeng(en) | Zielgewebe | Sonstige Vorschriften (gemäß Artikel 14 Absatz 7 der Verordnung (EG) Nr. 470/2009) | Therapeutische Einstufung |
|---|---|---|---|---|---|---|
| Sulfonamide (alle Stoffe der Sulfonamidgruppe) | Muttersubstanz | Alle zur Lebensmittel-erzeugung genutzten Arten | 100 µg/kg | Muskel
Fett Leber Nieren |
Die Rückstände aller Stoffe der Sulfonamidgruppe dürfen insgesamt 100 µg/kg nicht überschreiten.
Für Fisch betrifft der Muskel-Rückstandshöchstmengenwert "Muskel und Haut in natürlichen Verhältnissen". Die Rückstandshöchstmengen-werte für Fett, Leber und Nieren gelten nicht für Fisch. Nicht zur Anwendung bei Tieren, deren Eier für den menschlichen Verzehr bestimmt sind. |
Mittel gegen Infektionen/Chemo-therapeutika |
| Rinder, Schafe, Ziegen | 100 µg/kg | Milch |
Wechselwirkungen
Bei gleichzeitiger Verabreichung von Lokalanästhetika aus der Gruppe der para-Aminobenzoesäureester (zum Beispiel Procain oder Tetracain) kommt es zu einem Antagonismus, da diese die Wirkung von Sulfonamiden aufheben. Weiterhin kommt es zu unerwünschten Wechselwirkungen mit Methenamin und zum Teil auch mit Phenylbutazon.
Nebenwirkungen
Sulfonamide sind nicht für die Schwangerschaft zugelassen, vor allem nicht um den Geburtstermin herum, da sie beim Neugeborenen eine gefährliche Hyperbilirubinämie verursachen können. Zum anderen können Allergien bestehen, vor allem auf der Haut – hier können Sulfonamide auch eine starke Phototoxizität auslösen. Selten kommen Blutbildveränderungen oder hepatische Cholestase vor, wie bei den Sulfonylharnstoffen. Bei Patienten mit erblichen Methämoglobinämien „führt eine Medikation mit Sulfonamiden zu schweren hämolytischen Krisen.“[39]
Außerdem wird die Kammerwasserbildung gehemmt, da Sulfonamide die Wirkung der Carboanhydrase hemmen. Dies führt zu einer effektiven Senkung des Augendrucks. Augentropfen mit modifizierten Sulfonamiden werden deswegen heute als Mittel der ersten Wahl bei der Behandlung des Glaukoms verwendet.
Anmerkungen
- ↑ S. Y. Hwang, D. A. Berges, J. J. Taggart, C. Gilvarg: Portage transport of sulfanilamide and sulfanilic acid. In: Journal of Medicinal Chemistry. Band 32, Nr. 3, März 1989, S. 694–698, doi:10.1021/jm00123a034, PMID 2645404.
- ↑ Stephan P. Blum, Tarik Karakaya, Dieter Schollmeyer, Artis Klapars, Siegfried R. Waldvogel: Metal‐Free Electrochemical Synthesis of Sulfonamides Directly from (Hetero)arenes, SO2, and Amines. In: Angewandte Chemie International Edition. Band 60, Nr. 10, 1. März 2021, ISSN 0570-0833, S. 5056–5062, doi:10.1002/anie.202016164 (wiley.com [abgerufen am 9. April 2021]).
- ↑ a b c d e f L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1191.
- ↑ a b L. F. Fieser, M. Fieser In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1193.
- ↑ Nicolai Guleke: Kriegschirurgie und Kriegschirurgen im Wandel der Zeiten. Vortrag gehalten am 19. Juni 1944 vor den Studierenden der Medizin an der Universität Jena. Gustav Fischer, Jena 1945, S. 14–15.
- ↑ L. F. Fieser, M. Fieser In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1182.
- ↑ Brockhaus der Naturwissenschaften und der Technik. 4. Auflage. Brockhaus, Wiesbaden 1958, S. 480.
- ↑ L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1183.
- ↑ Brockhaus der Naturwissenschaften und der Technik. 4. Auflage. Brockhaus, Wiesbaden 1958, S. 553.
- ↑ Wolf-Dieter Müller-Jahncke: Sulfonamide. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 1367.
- ↑ Die Entwicklung von Prontosil wird dargestellt in John Lesch, The first miracle drugs, Oxford UP 2007, S. 57ff.
- ↑ W-Dieter Müller-Jahncke: Sulfonamide. 2005, S. 1367.
- ↑ Lesch, The first miracle drugs, S. 82.
- ↑ Domagk Beitrag zur Chemotherapie der bakteriellen Infektionen. In: Deutsch. Med. Wochenschrift. Band 61, 15. Februar 1935, S. 250–253;
Domagk Chemotherapie der bakteriellen Infektionen. In Angewandte Chemie. Band 46, 1935, S. 657–667. - ↑ Zur Geschichte der Sulfonamide auch John Lesch The miracle drugs. Oxford University Press 2006.
- ↑ Lesch, The miracle drugs, Kapitel 4, Into the maelstrom, S. 71ff
- ↑ J. und Th. Tréfouël, F. Nitti, D. Bovet, « Activité du p.aminophénylsulfamide sur l’infection streptococcique expérimentale de la souris et du lapin », C. R. Soc. Biol. 120, 23. November 1935, S. 756.
- ↑ Lesch, The making of the first miracle drugs, S. 84.
- ↑ Lesch, The first miracle drugs, S. 83f.
- ↑ Brockhaus der Naturwissenschaften und der Technik. 4. Auflage. Brockhaus, Wiesbaden 1958, S. 411.
- ↑ L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1196. wird nicht Dunn, sondern Chain als 2. Forscher angeführt.
- ↑ L. F. Fieser, M. Fieser: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1194.
- ↑ Günter Clauser: Funktionelle Störungen des Wasserhaushalts. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1255 f., hier: S. 1255.
- ↑ H. Auterhoff: Lehrbuch der Pharmazeutischen Chemie. WVG 1978, 472 ff.
- ↑ Herder Lexikon Chemie. Lizenzausgabe für Bertelsmann Club, Gütersloh, Buch-Nr. 03838 0, S. 232.
- ↑ Eintrag zu Sulfonamid-Antibiotika im Flexikon, einem Wiki der Firma DocCheck, abgerufen am 25. November 2015. (Punkt 3).
- ↑ Zámečník: Das war Dachau. Stiftung Comité International de Dachau, Luxemburg 2002, S. 285 ff.
- ↑ alle Angaben, sofern nichts anderes angegeben, aus der Datenbank CliniPharm
- ↑ pubchem: Sulfathiourea.
- ↑ Frank A. Plumer et al.; In: N Engl. J. Med.; 1983, 309, S. 67–71.
- ↑ Eintrag zu Sulfamerazin bei Vetpharm, abgerufen am 23. Juni 2012.
- ↑ The Clinical Performance of Sulfamoxole, A New Sulfonamide Analysis of 1240 Case Reports (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. .
- ↑ www.vetpharm.uzh.ch.
- ↑ MedlinePlus Drug Information: Erythromycin and Sulfisoxazole.
- ↑ Anderson EA, Knouff EG, Bower AG; In: Calif. Med. 1956 May; 84 (5):329-30.
- ↑ Junyi Xu & Claudia Gallert & Josef Winter, Appl Microbiol Biotechnol (2007) 74:493–500.
- ↑ Eintrag zu Sulfonamide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juni 2011.
- ↑ Verordnung (EU) Nr. 37/2010 der Kommission vom 22. Dezember 2009 über pharmakologisch wirksame Stoffe und ihre Einstufung hinsichtlich der Rückstandshöchstmengen in Lebensmitteln tierischen Ursprungs. Abgerufen am 6. Februar 2019.
- ↑ M. Buchta: Molekulare Grundlagen der Humangenetik. In: M. Buchta, D. W. Höper, A. Sönnichsen: Das Hammerexamen. Repetitorium für den 2. Abschnitt der Ärztlichen Prüfung. 1. Auflage. Elsevier, München 2006, S. 1426.


