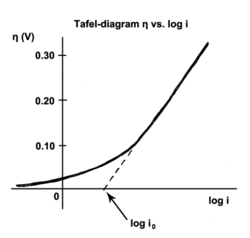
Tafel-Gleichung
Die Tafel-Gleichung beschreibt im Bereich der Elektrochemie näherungsweise den Zusammenhang zwischen der Stromdichte an einer Elektrode und dem Elektrodenpotential. Sie ist nach Julius Tafel benannt, der sie 1905 empirisch fand.[1] Die Tafel-Gleichung ist hilfreich bei Berechnungen der Zellspannung elektrochemischer Zellen, vor allem bei der Elektrolyse. Auch für die Diskussion des Spannungsabfalls in einer Brennstoffzelle bei einem gegebenen Strom ist sie wichtig, hier lautet eine Aussage der Gleichung:
- Bei gegebenem Strom ist der elektrochemisch bedingte Spannungsabfall umso niedriger, je höher der Austauschstrom der Zelle ist.
Der Austauschstrom ist abhängig von dem in der Brennstoffzelle verwendeten Katalysator. Daher ist es ein Ziel der Weiterentwicklung von Brennstoffzellen, Katalysatoren zu finden, die diesen Strom maximieren.
Formel der Tafel-Gleichung
Die Tafel-Gleichung gilt nur näherungsweise in einem mittleren Strombereich. Für kleinere Stromstärken bzw. kleinen Überspannungen muss die genauere Butler-Volmer-Gleichung verwendet werden.
Hierin sind:
: der Spannungsabfall
: die allgemeine Gaskonstante
: die absolute Temperatur
: Durchtritts- oder Symmetriefaktor
: Zahl der übertragenen Elektronen
: die Faraday-Konstante
: die Austauschstromdichte
: die Stromdichte
Einzelnachweise
- ↑ Julius Tafel: Über die Polarisation bei kathodischer Wasserstoffentwicklung. In: Wilhelm Ostwald, J. H. van't Hoff (Hrsg.): Zeitschrift für physikalische Chemie, Stöchiometrie und Verwandtschaftslehre. Band 50. Wilhelm Engelmann, Leipzig 1905, S. 641–712, doi:10.1515/zpch-1905-5043 (PDF).