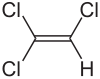
Trichlorethen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trichlorethen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2HCl3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit süßlich-etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 131,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,46 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
87 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (1 g·l−1)[1] | ||||||||||||||||||
| Brechungsindex |
1,4782 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4]; zulassungspflichtig[5] | ||||||||||||||||||
| MAK |
Schweiz: 20 ml·m−3 bzw. 110 mg·m−3[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−43,6 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Trichlorethen (Trivialname: Trichlorethylen, Trichlor, Tri) ist eine farblose, klare Flüssigkeit. Sie riecht nach Chloroform und ist unentzündlich. Sie wirkt als starkes Lösungsmittel und wurde deshalb früher in Formen- und Walzenwaschmitteln in der Druckindustrie und in metallverarbeitenden Betrieben als Teilereinigungsmittel eingesetzt.
Trichlorethen löst Polyolefine und chemisch verwandte Kunststoffe an und macht sie weich und undurchsichtig.
Gewinnung und Darstellung
Bis Anfang der 1970er-Jahre wurde Trichlorethen meist in einem Zwei-Schritt-Verfahren aus Ethin hergestellt. Zunächst wird Ethin mit Chlor und einem Eisenchlorid-Katalysator bei 90 °C zu 1,1,2,2-Tetrachlorethan umgesetzt:[9]
Das 1,1,2,2-Tetrachlorethan wurde dann zu Trichlorethen dehydrochloriert. Dies kann entweder mit einer wässrigen Lösung von Calciumhydroxid[10]
oder in der Gasphase durch Erhitzen auf 300–500 °C mit einem Barium- oder Calciumchlorid-Katalysator geschehen:
Heute wird Trichlorethen meist aus Ethen produziert. Dieses wird zuerst mit Hilfe eines Eisenchlorid-Katalysator durch Chlorierung in 1,2-Dichlorethan umgewandelt
und dann bei 400 °C mit zusätzlichem Chlor in Trichlorethen umgewandelt.
Diese Reaktion kann durch eine Vielzahl von Stoffen katalysiert werden. Der am häufigsten verwendete Katalysator ist eine Mischung aus Kaliumchlorid und Aluminiumchlorid. Allerdings können auch verschiedene Formen von porösem Kohlenstoff verwendet werden. Diese Reaktion produziert als Nebenprodukt auch Tetrachlorethen, welches, je nach Menge von zugeführtem Chlor, auch Hauptprodukt werden kann. Typischerweise werden Trichlorethen und Tetrachlorethen gesammelt und dann durch Destillation abgetrennt.[2]
Verwendung
Aufgrund seiner guten fettlösenden Eigenschaft, der Flüchtigkeit und Nichtbrennbarkeit ist Trichlorethen, neben verwandten Verbindungen wie z. B. Tetrachlorethen, eines der gebräuchlichsten Reinigungs-, Entfettungs- und Extraktionsmittel gewesen. Es fand beispielsweise Verwendung in der Metall- und Glasindustrie, bei der chemischen Reinigung und in der Textilbearbeitung. Noch heute ist es von Bedeutung als Schwerflüssigkeit bei Mineralien und als Zwischenprodukt bei chemischen Synthesen. Außerdem wird es in der Bitumen- und Asphaltindustrie als Lösemittel für Bitumen verwendet.
Sicherheitshinweise und gesetzliche Regelungen
Trichlorethen ist gesundheitsschädlich und stark narkotisierend: Das Einatmen von Luft mit 200 ppm führt zu Müdigkeit. Akute Vergiftungen führen zu Hirnschäden, Erblindung und zur Aufhebung der Geruchs- und Geschmacksempfindung. Trichlorethen wird als krebserzeugend (vor allem Nierenkrebs) (Kategorie 1B) und keimzellmutagen (Kategorie 2) eingestuft.[1][11]
Im Körper wird es durch Monooxygenasen zu Trichlorethenoxid, Trichloracetaldehyd, Trichlorethanol und Trichloressigsäure umgewandelt. Trichlorethanol wird glukoronidiert und mit dem Urin ausgeschieden, während sich die Trichloressigsäure wegen ihrer starken Bindung an Eiweiße des Blutplasma anreichert und neurotoxisch wirkt.
In der Europäischen Union gilt für Trichlorethen ein Arbeitsplatzgrenzwert von 10 ppm (54,7 mg/m3) für 8-Stunden-TWA und von 30 ppm (164,1 mg/m3) für STEL (15 Min.).[12] In den USA beträgt der Grenzwert 50 ppm. Die VOC-Richtlinie 1999/13/EG[13] und die Richtlinie über Industrieemissionen 2010/75/EU[14] stellen verbindliche Mindestanforderungen für die Emissionen von Trichlorethylen für die Umwelt, einschließlich der Emissionen für die Reinigung von Oberfläche. Aktivitäten mit einem Lösemittelverbrauch unterhalb einer vorgegebenen Schwelle sind durch diese Mindestanforderungen nicht abgedeckt.
Trichlorethen wurde im Juni 2010 aufgrund seiner Einstufung als carcinogen (Carc. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[4] Danach wurde Trichlorethen im April 2013 in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. April 2016 aufgenommen.[5][15]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Trichlorethylen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Environmental Health Criteria (EHC) für Trichlorethylen, abgerufen am 19. November 2014.
- ↑ Eintrag zu Trichloroethylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ a b Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 79-01-6 bzw. Trichlorethen), abgerufen am 2. November 2015.
- ↑ Eintrag zu Trichloroethylene in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ Lawrence Fishbein, Potential Industrial Carcinogens and Mutagens, ISBN 978-0-444-41777-0.
- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, S. 252, ISBN 978-3-11-024894-4.
- ↑ IARC Monograph 106 - Trichlorethen, 2014
- ↑ Richtlinie (EU) 2019/130
- ↑ eur-lex.europa.eu: VOC-Richtlinie 1999/13/EG (PDF)
- ↑ eur-lex.europa.eu: Richtlinie über Industrieemissionen 2010/75/EU (PDF)
- ↑ Verordnung (EU) Nr. 348/2013






