Ethen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
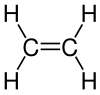
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ethen (IUPAC) | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C2H4 | ||||||||||||
| Kurzbeschreibung |
hochentzündliches, farbloses Gas mit schwach süßlichem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 28,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte |
1,178 kg·m−3 (15 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−103,8 °C[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (130 mg·l−1)[1] | ||||||||||||
| Dipolmoment |
0[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
Schweiz: 10000 ml·m−3 bzw. 11500 mg·m−3[4] | ||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
52,4 kJ/mol (Gas)[5] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Ethen (auch Äthen, Ethylen oder älter Äthylen) ist eine gasförmige, farblose, brennbare, süßlich riechende organische Verbindung mit der Summenformel C2H4. Es ist das einfachste Alken, ein ungesättigter Kohlenwasserstoff mit einer Kohlenstoff-Kohlenstoff-Doppelbindung.
Ethen wird kommerziell durch Steamcracken einer Vielzahl von Kohlenwasserstoffen hergestellt. In Europa und Asien wird Ethen überwiegend auf Naphtha- oder Gasöl-Basis produziert, in den Vereinigten Staaten, Kanada und dem Nahen Osten auch aus Ethan, Propan und Flüssiggas.
Ethen ist die meistproduzierte organische Grundchemikalie und wird für die Herstellung primärer Folgeprodukte wie Polyethylen, Ethylenoxid, Styrol oder α-Olefine verwendet.
Pflanzen wie reife Äpfel und Birnen sowie einige Beeren sowie die Japanische Rotkiefer strömen Ethen aus, und es ist als Reifegas z. B. für Bananen und als Phytohormon von Bedeutung.
Geschichte
Im alten Ägypten wurde Ethen unbewusst zum Reifen von Maulbeer-Feigen genutzt. Dazu wurden die unreifen Früchte angeritzt. Diese produzierten daraufhin Ethen und beschleunigten den Reifeprozess.[6] Die erste Erwähnung von Ethen als Gas findet sich im Jahr 1669 in dem Werk Actorum Laboratorii Chymici Monacensis, seu Physicae subterraneae des deutschen Alchemisten Johann Joachim Becher. Becher erhielt das Gas durch Erhitzen von Ethanol mit Schwefelsäure.[7]
Bereits 1777 soll der niederländische Mediziner Jan Ingenhousz über die in Amsterdam erfolgte Synthese von Ethen durch Henricus Aeneae (Enée) und dessen Mitarbeiter John Cuthbertson erfahren haben.[8][9] Im Jahr 1795 wurde von den vier niederländischen Chemikern Johan Rudolph Deiman, Adriaan Paets van Troostwijk, Anthonie Lauwerenburgh und Nicolaas Bondt die Synthese von 1,2-Dichlorethan aus Ethen und Chlor entdeckt. Da das Produkt als Öl der holländischen Chemiker bezeichnet wurde, wurde das 1669 von Becker entdeckte und 1799 von Joseph Priestley untersuchte[10] Ethen (im Deutschen ursprünglich Äthylen) im Französischen gaz oléfiant („ölbildendes Gas“), im Englischen olefiant gas, genannt.[11] 1807 versuchte John Dalton eine Strukturformel aufzustellen. In der zweiten Hälfte des 19. Jahrhunderts gelang die synthetische Darstellung pflanzlicher Säuren wie zum Beispiel der Bernsteinsäure aus Ethen.
Technisch wurde Ethen zunächst durch Dehydratisierung von Ethanol oder durch Isolierung aus Kokereigas gewonnen. Eine erste großtechnische Herstellung von Ethen aus Ethanol erfolgte 1913 in den Elektrochemischen Werken in Bitterfeld.[12] Das so gewonnene Ethen wurde zu Kühlzwecken benutzt. Erst 1981 wurde der Prozess in Brasilien von Salgema Indústrias Químicas wieder aufgenommen. Salgema produzierte etwa 100.000 Tonnen pro Jahr, basierend auf einem Patent der Petrobras. Ausgangsmaterial für das „Green Ethylene“ ist Ethanol aus Zuckerrohr. Im Jahr 2010 errichtete die Braskem ein Werk zur Dehydratisierung von Ethanol in Triunfo in Rio Grande do Sul mit einer Jahreskapazität von 200.000 Tonnen.[12]
Das technisch relevante Verfahren ist heute das Steamcracken von Naphtha oder höheren Kohlenwasserstoffgemischen wie Hydrowax.
Ethen kann bei geeigneten Prozess-Bedingungen mit Alumina-Titandioxid-Katalysatoren unter Dehydratisierung aus Methanol beziehungsweise dessen Folgeprodukt Dimethylether erhalten werden. Im Labor wird es durch Dehalogenierung von 1,2-Dichlorethan mit Zink gewonnen.
Gewinnung und Darstellung
Ethen fällt teilweise als Koppelprodukt an, doch der Großteil des benötigten Ethens wird durch thermisches oder katalytisches Cracken von Kohlenwasserstoffen gewonnen. Als Rohmaterial wird meist Erdgas, Naphtha oder höhersiedende Destillatschnitte verwendet. Neben dem Cracken ist die Dehydrierung von Ethan, das in großen Mengen in Schiefergasen vorkommt, eine technische Route. Die Dehydratisierung von Ethanol spielt in Ländern mit großen Bioethanolproduktion eine wichtige Rolle.
Im Jahr 2010 wurden weltweit etwa 123 Millionen Tonnen an Ethen hergestellt. Die Produktion in Deutschland betrug 5,1 Millionen Tonnen.[13]
Ethen-Distribution
In Deutschland und Teilen der Niederlande besteht ein Ethen-Pipelinesystem zum Transport zwischen den Chemiestandorten von Rotterdam über Antwerpen in den Raum Köln und in den Emscher-Lippe-Raum sowie in das Rhein-Main-Gebiet und nach Ludwigshafen am Rhein.
In Bayern besteht eine Pipeline zwischen dem Chemiedreieck im Süd-Osten und dem Chemiestandort bei Ingolstadt (Ethylen-Pipeline Münchsmünster-Gendorf). Mit Inbetriebnahme der 370 km langen Ethylen-Pipeline Süd von Münchsmünster nach Ludwigshafen am Rhein im Juli 2013 wurde das nordwest-deutsche Netz mit den bayerischen Chemiestandorten verbunden.[14]
Eigenschaften
Moleküleigenschaften
Zwischen den beiden Kohlenstoff-Atomen besteht eine Doppelbindung. Für eine Rotation um diese Bindung ist ein erheblich größerer Energieaufwand nötig als für die Rotation um eine Einfachbindung zwischen zwei Kohlenstoffatomen. Aufgrund der sp2-Hybridisierung der Kohlenstoffatome ist das Molekül planar, das heißt, alle Atome liegen in einer Ebene. Die H-C-H-Bindungswinkel betragen jeweils 117° und weichen damit nur leicht vom theoretisch idealen Wert der trigonal planaren Form mit 120° ab. Die C=C-Doppelbindung ist mit einer Bindungslänge von 133 pm deutlich kürzer als die C-C-Einfachbindung in Ethan (154 pm). Die beiden Bindungen zwischen den Kohlenstoffatomen in Ethen sind jedoch nicht gleich stark: Die Bindungsenergie der σ-Bindung beträgt circa 450 kJ/mol, die der π-Bindung circa 270 kJ/mol (siehe auch σ-π-Modell). Entsprechend lässt sich die π-Bindung, beispielsweise in einer chemischen Reaktion, leichter spalten. Allgemein ist Ethen aufgrund der hohen Elektronendichte zwischen den beiden Kohlenstoff-Atomen wesentlich reaktiver als zum Beispiel das einfach gebundene Ethan.
Physikalische Eigenschaften
Auf Grund der reaktiven C=C-Doppelbindung ist die Addition an diese Bindung eine typische Reaktion des Ethens. In Wasser sind nur 130 mg/l Ethen löslich, in organischen (unpolaren) Lösungsmitteln ist Ethen jedoch gut löslich. Ethen hat einen leicht süßlichen, unangenehmen Geruch. Die Geruchsschwelle liegt bei 260 ml/m3. Der Heizwert von Ethen beträgt 47,2 MJ/kg.[15]
Weitere Eigenschaften:
- Molare Schmelzenthalpie: 3,35 kJ/mol
- Molare Verdampfungsenthalpie: 13,9 kJ/mol
- Cp: 42,9 J/(mol·K)
- ΔfH0g: 52,47 kJ/mol
- S0: 219,32 J/(mol·K)
Ethen kristallisiert bei −175 °C in einer rhombischen Elementarzelle mit zwei Molekülen pro Zelle und den Gitterparametern a = 6,46 Å, b = 4,87 Å, c = 4,14 Å.[16] Die Dichte beträgt 0,717 g/cm3.
Der Flammpunkt liegt bei −136 °C, der Zündpunkt bei 425 °C.
Chemische Eigenschaften
Reaktionen unter Bildung einer Kohlenstoff-Kohlenstoff-Bindung
Ethenmoleküle polymerisieren, radikalisch unter hohem Druck oder mit Hilfe von Ziegler-Katalysatoren zu Polyethylen.[17]
Mit anderen Olefinen wie Propylen reagiert Ethen zu Ethylen-Propylen-Copolymeren, unter Zusatz von Dienen zu Ethylen-Propylen-Dien-Kautschuk.[18]
Mit Tetrafluorethylen reagiert Ethen zu Ethylen-Tetrafluorethylen, mit anderen ungesättigten Verbindungen zu Copolymeren.
Unter Nickelkatalyse lässt sich Ethen zu α-Olefinen oligomerisieren. Innenständige Olefine können mit Ethen unter Metathese in α-Olefine überführt werden. Beide Reaktionen werden großtechnisch im SHOP-Prozess angewandt.
Die Hydroformylierung von Ethen mit Kohlenstoffmonoxid und Wasserstoff ist ein technischer Weg zur Darstellung von Propanal.
Durch Nickelkatalysatoren wird die Hydrocyanierung von Ethen mit Cyanwasserstoff zu Propionitril katalysiert. Durch Hydrierung oder Hydrolyse entsteht Propylamin oder Propionsäure.
Ethen reagiert in einer En-Reaktion, einer pericyclische Reaktion mit einer Verbindung, die Wasserstoff in allylischer Position unter Bindungsbildung zwischen einem Kohlenstoffatom der Doppelbindung und dem Enophil unter Übertrag des allylischen Wasserstoffs auf das Enophil.
Reaktionen unter Bildung einer Sauerstoff-Kohlenstoff-Bindung
Ethen verbrennt bei ausreichender Sauerstoffzufuhr zu Wasser und Kohlendioxid.
Mit Luft oder Sauerstoff und Silber als Katalysator erfolgt bei einer Temperatur von 220 bis 280 °C und erhöhtem Druck eine Epoxidation zu Ethylenoxid. Durch weitere Umsetzung mit Wasser entsteht Ethylenglycol.
Durch Umsetzen mit Schwefelsäure entsteht ein Schwefelsäurehalbester, der durch Hydrolyse in Ethanol umgesetzt werden kann. Diese Syntheseroute zum Industriealkohol wurde durch die Phosphorsäure katalysierte Umsetzung mit Wasser ersetzt.
Im Wacker-Hoechst-Verfahren wird Ethen unter Palladium-Katalyse zu Acetaldehyd oxidiert. Die Reaktion wird durch folgende Gleichungen dargestellt:
Metallorganische Verbindungen

Von dem dänischen Chemiker William Christopher Zeise wurde 1830 die erste metallorganische Verbindung mit einem Ethen-Liganden, das Zeise-Salz mit der Summenformel K[PtCl3(C2H4)]H2O, synthetisiert.[19] Mit Übergangsmetallen bildet Ethen π-Komplexe.
Sonstige Reaktionen
Bei Hitze und unter Luftabschluss zerfällt Ethen zu Methan und Kohlenstoff.
Ethen reagiert mit Chlor zu 1,2-Dichlorethan (Additionsreaktion).
Ethen reagiert mit Wasserstoff unter hohem Druck und der Anwesenheit von metallischen Katalysatoren wie Platin und Nickel zu Ethan (Hydrierung).
Verwendung

Die wichtigsten Folgeprodukte des Ethens sind Polyethylen (56 %), d. h. die Kunststoffsorten HDPE, LDPE und LLDPE, Ethylendichlorid zur Herstellung von PVC (14 %), Ethylenoxid (11 %) zur Herstellung des Polyester-Vorprodukts Ethylenglycol oder zum Beispiel von nichtionischen Tensiden (Waschmittel) sowie Ethylbenzol (7 %) zur Herstellung von Polystyrol. Das bedeutet, dass mehr als 75 % des Ethens zur Herstellung von Kunststoffen verwendet wird.[20]
Daneben ist Ethen Ausgangsstoff zur Herstellung zahlreicher organischer Verbindungen wie Anthracen, 2-Chlorethanol, Chlorethan, Propanal, Isopren, Vinylacetat, Propansäure, Buten, Styrol, Ethandiol und weiteren Stoffen. Im Wacker-Hoechst-Verfahren wird Ethen großtechnisch unter Verwendung von molekularem Sauerstoff in Acetaldehyd (Ethanal) umgesetzt (etwa 1,3 % des Ethenverbrauchs).
Auf die anästhetischen Eigenschaften von Ethen hatte 1864 der Physiologe Ludimar Hermann hingewiesen.[21] Das Gas war als Betäubungsmittel neben Lachgas vor allem bei schwachen Betäubungen in Gebrauch. Es wirkt narkotisch und muskelentspannend. Im Jahr 1923 wurde es in Chicago zum ersten Mal öffentlich benutzt, die narkotische Wirkung des Ethens ist etwas stärker als die des Lachgases und hat einen ähnlichen Wirkmechanismus. Nach der 1923 erschienenen Publikation von A. Luckhardt und J. B. Carter von der Universität Chicago über Narkosen mit Ethen bei über 100 Operationen fand es zunächst vermehrt Anwendung.[22][23] Heute wird es jedoch nicht mehr verwendet, da es brennbar bzw. in Verbindung mit Sauerstoff hoch explosibel ist und unangenehm riecht. Außerdem ist die Narkosewirkung des Ethens im Vergleich zu anderen gebräuchlichen Betäubungsmitteln nicht sehr gut; um eine gute Wirkung zu erzielen, müsste das Narkosegemisch mindestens 80 % Ethen enthalten.
Auch zum Reifen unreifer Früchte wie Äpfel, Bananen und Tomaten sowie zur Induktion der Blütenbildung wird es benutzt, entweder durch Begasung in geschlossenen Gewächshäusern oder im Freien über Wirkstoffe, die Ethen in der Pflanzenzelle freisetzen, wie z. B. Ethephon oder Etacelasil. Ethen ist des Weiteren ein Brenngas und wird für Hochgeschwindigkeits-Flammspritzen verwendet. Ethen ist in der chemischen Industrie Ausgangsstoff für die Synthese von über 30 % aller Petrochemikalien, es hat das Ethin nach dem Zweiten Weltkrieg weitestgehend verdrängt, weil Ethin teurer herzustellen ist, wohingegen Ethen bei industriellen Prozessen massenhaft anfällt, seitdem Erdöl in großen Mengen zu Verfügung steht.
Außerdem wird es zur Herstellung von Schädlingsbekämpfungsmitteln und chemischer Waffen wie dem Senfgas (2,2-Dichlordiethylsulfid) verwendet.
Während des Zweiten Weltkrieges wurde Ethengas von dem Spezialtrupp Taifun beim Angriff auf Festungen experimentell eingesetzt.
Biologische Wirkung
Ethen ist ein Phytohormon (Pflanzenhormon). Es wird von Pflanzen ausgehend von der Aminosäure Methionin synthetisiert, teilweise stimuliert durch das Phytohormon Auxin. Als Hormon beeinflusst es das Keimwachstum und die Seneszenz bei Pflanzen. Es bewirkt die Fruchtreifung, die Entwicklung der Blüten, den Abwurf der Blätter im Herbst sowie das Absterben von Pflanzenteilen. Als gasförmigen Stoff findet sich Ethen dabei vor allem in den Räumen zwischen den Zellen, den Interzellularen.
Bereits 1901 zeigte Dimitri Neljubow, dass Ethen bei Pflanzen die so genannte „Triple Response“ auslöst. Diese tritt bei keimenden Wurzeln auf, die mit Ethen begast werden. Aufgefallen war der Effekt bei Pflanzen an defekten Stadtgasleitungen, die ein ungewöhnliches Wachstum zeigten. Es handelt sich dabei um eine Hemmung des Längenwachstums in Zusammenwirken mit einer Verdickung des Stängels und eine Deaktivierung des Gravitropismus, also des Wachstums in Richtung der Erdanziehungskraft. Diese Wirkung kommt zustande durch eine Umorientierung der Microtubuli, die als Skelettstrukturen die Wachstumsrichtung (Anlagerung von Cellulosefasern) des Keimes vorgeben. Sie werden von einer vertikalen in eine horizontale Orientierung gebracht. Als biologischer Sinn wird die Überwindung von Hindernissen angenommen: Ethen wird während des gesamten Wachstums gebildet und staut sich vor Hindernissen, an diesen kommt es zum Dickenwachstum und somit zu einer größeren Kraftentfaltung durch die Wurzelspitze.
Die zweite Funktion des Ethens bezieht sich auf verschiedene Alterungsprozesse der Pflanze. Dazu gehören sowohl die Reifung von Früchten und die Entwicklung von Blüten als auch der Abwurf von Blättern (Abszission) oder das Absterben von Pflanzenteilen (Seneszenz). Wichtig für diese Funktionen ist die lawinenartige Steigerung der verfügbaren Ethenmenge, die dadurch zustande kommt, dass die Synthese von Ethen durch die Präsenz desselben aktiviert wird. Auf diese Weise reift etwa eine Frucht an allen Stellen zugleich. Die Wirkung bei der Reifung von Früchten wird in der Landwirtschaft ausgenutzt, um unreif geerntete Früchte nachträglich zu Stoffwechselvorgängen zu veranlassen, die die Früchte reifen lassen.
Seit Mitte der 1990er Jahre werden durch gezielte Genveränderung Tomaten hergestellt, die besonders haltbar sind (Flavr-Savr-Tomaten). Das für die Herstellung des Ethens zuständige Gen wird dabei ausgeschaltet. Diese Tomaten können dann nach Bedarf mit Ethen begast werden und dadurch reif gemacht werden. Häufig werden Früchte beabsichtigt nicht zum Reifen gebracht, dann transportiert, und erst am Zielort mit Hilfe von Ethen gereift. Unreife Tomaten können reif gemacht werden, indem einige reife Tomaten dazugelegt werden. Diese sondern Ethen ab und bringen die unreifen Tomaten so zum Reifen.
Ebenfalls essentiell ist Ethen als „Alarmstoff“ bei Schädlingsbefall an der Pflanze sowie bei Verwundungen. Gemeinsam mit anderen Stoffen wie der Salicylsäure und Jasmonat bewirkt das Ethen eine Abgrenzung des betroffenen Bereiches sowie die Bereitstellung von pflanzlichen Giften. Als Gas wirkt Ethen dabei auf benachbarte Pflanzenteile oder Pflanzen und setzt dort die Alarmkaskade in Gang. So kommunizieren Akazien über die Ausscheidung von Ethen an umstehende Akazien Gefahr, wenn sie von Antilopen oder Giraffen beweidet werden, wie eine Studie von Sylvia Hughes zeigt.[24]
Der Wirkmechanismus des Ethens ist wie bei anderen Phytohormonen noch sehr wenig erforscht. Es wird angenommen, dass Ethen auf spezifische Rezeptormoleküle (Ethenrezeptor ETR) an den Zellmembranen wirkt, die innerhalb der Zelle eine Wirkkaskade in Gang setzen. Konkret handelt es sich dabei um die Inaktivierung der Serin/Threoninkinase CTR1[25][25]. Das Signal wird weitergegeben an verschiedene Zellkern-Proteine (EIN3/EIL-Proteine), die als Transkriptionsfaktoren bei der Genexpression wirken und somit bestimmte Gene aktivieren. Das erste bekannte Zielgen dieser Proteine wurde als Ethen-Response-Faktor 1 (ERF1) beschrieben. Dieser Faktor steuert wiederum mehrere Gene, sodass bei der Wirkung von Ethen auf dieses System immer eine ganze Reihe von genetischen Aktivitäten ausgelöst wird. Bei der Fruchtreifung müssen etwa verschiedene Enzyme zur Erweichung der Zellwand gebildet werden, bei der Seneszenz chitin- und celluloseabbauende Enzyme (Chitinasen, Cellulasen). Sehr umfangreich ist das Repertoire beim Pflanzenstress, also der durch Ethen ausgelösten Reaktion auf Schädlinge und Verwundungen. Produziert werden in dieser Situation unter anderen Chitinasen (als Abwehrstoff gegen Insekten), Glucanasen, Proteinase-Inhibitoren (Hemmstoffe für proteinabbauende Enzyme, gegen Pilze) und viele weitere Abwehrstoffe.
Die Ethen-Synthese in der Pflanze geht von der Aminosäure Methionin aus. Dabei entsteht in einem ersten Schritt durch die Kopplung an Adenosin das S-Adenosylmethionin (SAM). Aus dem Folgeprodukt 1-Aminocyclopropancarbonsäure (ACC) wird durch die ACC-Oxidase Ethen freigesetzt. Die Bildung der Oxidase wird durch Ethen selbst stimuliert, wodurch wie bei einer Kettenreaktion in benachbarten Zellen die Ethenbildung vorangetrieben wird.
Gefahren
Ethen verbrennt an der Luft mit leicht rußender, leuchtender Flamme. Ethen ist hochentzündlich. Ethenbehälter müssen an einem gut belüfteten Ort aufbewahrt werden. Von Zündquellen ist es fernzuhalten und es müssen Maßnahmen gegen elektrostatische Aufladung getroffen werden. In Volumenanteilen von 3 bis 36 Prozent in Luft bildet es explosive Gemische. In hoher Konzentration wirkt Ethen narkotisch.
Nachweis
Die Doppelbindung des Ethens kann mit Hilfe von Bromwasser nachgewiesen werden, da bei der Reaktion der beiden Stoffe das Brom unter Bildung von 1,2-Dibromethan verbraucht und dadurch das bräunliche Bromwasser entfärbt wird.
Literatur
- Klaus Lürssen: Das Pflanzenhormon Ethylen. Biosynthese, Wirkung auf Pflanzen und Anwendungsmöglichkeiten. In: Chemie in unserer Zeit. 15. Jahrg., Nr. 4, 1981, S. 122–129, doi:10.1002/ciuz.19810150405.
- Claus-Jürgen Estler: Pharmakologie und Toxikologie. Schattauer, Stuttgart 1992, 2000, ISBN 3-7945-1898-5.
- Gerhard Luft: Hochdruckpolymerisation von Ethylen. In: Chemie in unserer Zeit. 34. Jg., Nr. 3, 2000, S. 190–199, doi:10.1002/1521-3781(200006)34:3<190::AID-CIUZ190>3.0.CO;2-V.
Weblinks
- Eintrag zu Ethen. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Ethen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ Eintrag zu Ethylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-85-1 bzw. Ethen), abgerufen am 2. November 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ The Sycomore Fig (Html-Version) (Memento vom 8. Januar 2012 im Internet Archive), PDF-Version (593 kB) vom 30. Mai 2009.
- ↑ Winfried R. Pötsch, Annelore Fischer und Wolfgang Müller unter Mitarbeit von Heinz Cassebaum: Lexikon bedeutender Chemiker. Bibliographisches Institut, Leipzig 1988, ISBN 3-323-00185-0, S. 33–34.
- ↑ Appendix, §VIII, S. 474 ff., Experiments and observations relating to the various branches of natural philosophy: with a continuation of the observations on air, Joseph Priestley, London: printed for J. Johnson, 1779, Band 1.
- ↑ Seth C. Rasmussen: Acetylene and Its Polymers. 150+ Years of History. Springer, ISBN 978-3-319-95488-2, S. 9 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14.
- ↑ Eintrag zu Dichlorethane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- ↑ a b Pieter Imhof (Hrsg.), Jan Cornelis van der Waal (Hrsg.): Catalytic Process Development for Renewable Materials. Wiley-VCH Verlag, 2013, ISBN 978-3-527-33169-7, S. 25–27.
- ↑ Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 551.
- ↑ Oliver Konze: Pipeline zwei Wochen lang befüllt. Meldung im Donaukurier vom 13. September 2012.
- ↑ https://bauforumstahl.de/upload/documents/brandschutz/kennwerte/Heizwertstoffe.pdf
- ↑ W. H. Keesom, K. W. Taconis: An x-ray goniometer for the investigation of the crystal structure of solidified gases. In: Physica. 2, 1935, S. 463, doi:10.1016/S0031-8914(35)90116-1.
- ↑ Karl Ziegler - Consequences and development of an invention. (PDF; 633 kB) Abgerufen am 29. Mai 2013.
- ↑ Heike Kloppenburg, Thomas Groß, Martin Mezger, Claus Wrana: Das elastische Jahrhundert. Synthesekautschuke. In: Chemie in unserer Zeit. 43, 2009, S. 392–406, doi:10.1002/ciuz.200600515.
- ↑ Richard A. Love, Thomas F. Koetzle, Graheme J. B. Williams, Lawrence C. Andrews, Robert. Bau: Neutron diffraction study of the structure of Zeise's salt, KPtCl3(C2H4).H2O. In: Inorganic Chemistry. 14, 1975, S. 2653, doi:10.1021/ic50153a012.
- ↑ Marktstudie Ethylen von Ceresana Research, Dezember 2010
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14.
- ↑ Arno Benedict Luckhardt: Ethylene as a gas anaesthetic. Preliminary Communication. In: J. Amer. Med. Ass. Band 80, 1932, S. 1440 ff.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 14 und 26.
- ↑ Sylvia Hughes: Antelope activate the acacia's alarm system. Abgerufen am 9. Juni 2015.
- ↑ a b Schopfer, Peter. Brennicke, Axel. Mohr, Hans.: Pflanzenphysiologie. Spektrum Akademischer Verlag, 2010, ISBN 978-3-8274-2351-1.






![{\displaystyle n\ \mathrm {CH_{2}{=}CH_{2}\longrightarrow [-CH_{2}{-}CH_{2}-]} _{n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c5b6af3a6389e162b9365b78de1f79c8eb6735)





![{\displaystyle \mathrm {[PdCl_{4}]^{2-}+C_{2}H_{4}+H_{2}O\rightarrow CH_{3}CHO+Pd+2\ HCl+2\ Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/84f36753ba6922fdba1d1d36fe0f86d94c664f66)
![{\displaystyle \mathrm {Pd+2\ CuCl_{2}+2\ Cl^{-}\rightarrow [PdCl_{4}]^{2-}+2\ CuCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/572ed0fdcaf257aec043465677973e1a9651b67c)




