Thermorezeption
Als Thermorezeption oder Thermozeption wird der Temperatursinn von Lebewesen bezeichnet. Als entsprechende Rezeptoren dienen Nervenzell-Endigungen (Rezeptorzellen) in der Haut oder in den Schleimhäuten der Eingeweide. Sie erzeugen Aktionspotentiale (Nervenimpulse), deren Frequenz und zeitliche Muster sich in Abhängigkeit von der Temperatur verändern. Diese Impulse werden über die Nervenfasern und dann über mehrere neuronale Umschaltstellen bis zum Gehirn weitergeleitet. Thermorezeptoren bilden die Grundlage der Temperaturwahrnehmung. Außerdem wirken sie – im Zusammenspiel mit thermosensitiven Nervenzellen im Gehirn, vor allem in den thermoregulatorischen Zentren des Hypothalamus – an der Thermoregulation mit. Bei einigen Lebewesen sind Thermorezeptoren zu speziellen Sinnesorganen gebündelt, die der Orientierung (Navigation) oder der Beutefindung dienen (siehe Thermorezeption bei Tieren). Zu den Pionieren der wissenschaftlichen Erforschung des Temperatursinns gehören die Physiologen Ernst Heinrich Weber und Max von Frey. Für die Entdeckung der Thermorezeptoren erhielten David Julius und Ardem Patapoutian 2021 den Nobelpreis für Medizin.[1]
Wie die Schmerzwahrnehmung gehört der Temperatursinn zur Oberflächensensibilität. Für eine Übersicht siehe Sensibilität (Medizin).
Periphere Kalt- und Warmrezeptoren
Thermorezeptoren sind in der Lage, die Temperatur bzw. deren Änderung wahrzunehmen. Die entsprechenden Sensoren in der Haut und den Schleimhäuten registrieren die aktuelle Temperatur des Gewebes; eine Temperaturänderung kann beispielsweise durch Kontakt des Gewebes mit einem (temperierten) Objekt oder mit einem Medium (Luft) erfolgen sowie durch die Einwirkung von Strahlung (insbesondere von Infrarotstrahlung).
Die peripheren Thermorezeptoren lassen sich in elektrophysiologischen Experimenten eindeutig anhand der Reizabhängigkeit ihrer Impulsaktivität charakterisieren und von anderen Hautrezeptoren unterscheiden. Man kann dabei zwischen Kalt- und Warmrezeptoren unterscheiden. Dies entspricht den unterschiedlichen Empfindungsqualitäten kalt und warm beim Menschen („kalt“ ist z. B. nicht nur „weniger warm“).
Als Thermorezeptoren dienen Endigungen von Nervenzellen, deren Zellkörper in den Spinalganglien bzw. in den Ganglien der Hirnnerven (etwa des Nervus trigeminus) konzentriert sind. Diese „pseudounipolaren“ Neurone senden einerseits Ausläufer (Dendrit) in die Haut, wo sie als Freie Nervenendigungen nahe der Oberfläche auslaufen, andererseits zum Hinterhorn des Rückenmarks, wo die ankommenden „afferenten“ Signale auf weiterführende Nervenzellen umgeschaltet werden. Bei den Axonen handelt es sich um unmyelinisierte, langsam leitende C-Fasern (Warmrezeptoren und Kaltrezeptoren) bzw. um dünn myelinisierte, schneller leitende Aδ-Fasern (Kaltrezeptoren).
In den Handflächen eines Menschen findet man ein bis fünf Kaltpunkte pro Quadratzentimeter, aber nur 0,4 Warmpunkte. Diese Punkte entsprechen dem rezeptiven Feld eines einzelnen Thermorezeptors. Je nach Körperregion variiert die Dichte (Häufigkeit) der Sensoren stark: So finden sich auf den Lippen des Menschen bis zu 20 Kälterezeptoren pro cm². Die rezeptiven Felder von Kalt- und Warmrezeptoren überlappen nicht.
| Körperregion | Kaltpunkte pro cm² | Warmpunkte pro cm² |
|---|---|---|
| Stirn | 6,75 | 0,62 |
| Nase | 10,5 | 1 |
| Brust | 9 | 0,3 |
| Oberarm (Beugefläche) | 5,7 | 0,3 |
| Unterarm (Innenseite) | 6 | 0,4 |
| Handrücken | 7,4 | 0,54 |
| Oberschenkel | 4,85 | 0,39 |
Arbeitsweise der Rezeptoren
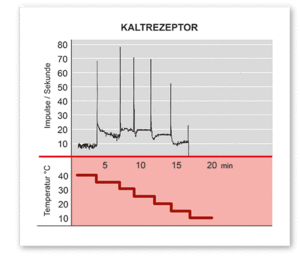
Warm- und Kaltrezeptoren erzeugen bei gleichbleibender Temperatur eine bestimmte, konstante Zahl an Aktionspotentialen (Impulse), die so genannte Spontanfrequenz. Eine plötzliche Temperaturveränderung beantworten die Rezeptoren mit einer sprunghaften, „überschießenden“ Änderung der Impulsfrequenz (dynamische Frequenz) bis auf einen Maximal- bzw. Minimalwert; anschließend pendelt sich die Frequenz auf einen neuen (höheren oder tieferen) Wert ein. Kaltrezeptoren reagieren auf eine Verringerung der Temperatur mit einem sprunghaften Anstieg der Frequenz, auf eine Erhöhung dagegen mit einem ebensolchen Abfall (siehe Abb. rechts); Warmrezeptoren antworten genau umgekehrt. Dabei werden jeweils Temperatursprünge von bis zu wenigen zehntel Grad beantwortet. Je größer der Temperatursprung ist und je rascher er abläuft, desto stärker ist auch die dynamische Antwort.[2]
Warmrezeptoren sind im Bereich zwischen knapp unter 30 bis knapp über 40 °C aktiv. Bei ihnen erhöht sich die Spontanfrequenz parallel zur Zunahme der Temperatur, fällt dann aber oberhalb eines Maximums wieder steil ab. Kaltrezeptoren sind empfindlich zwischen etwa 5 und fast 40 °C. Dynamische Empfindlichkeit sowie Spontanaktivität erreichen bei einer bestimmten mittleren Temperatur ein Maximum, das in der Regel bei etwa 20 bis 25 °C liegt. Zu höheren oder tieferen Temperaturen hin nehmen beide Parameter ab (Abb. links). Einige Kaltrezeptoren können bei rascher Erwärmung der Haut auf über 45 °C erneut aktiv werden. Dieses Phänomen ist möglicherweise für die so genannte paradoxe Kälteempfindung verantwortlich.
Von den Kalt- bzw. Warmrezeptoren zu unterscheiden sind so genannte Hitzerezeptoren. Diese erzeugen Aktionspotentiale erst bei Temperaturen, die als schmerzhaft empfunden werden, sprich ab etwa 43 °C. Sie werden meist auch durch andere schmerzhafte oder gewebeschädigende (noxische) Reize wie starken Druck aktiviert und daher den „polymodalen Nozizeptoren“ zugerechnet.
Auch die Aktivität der meisten Mechanorezeptoren wird von der Temperatur beeinflusst. Spontan aktive Mechanorezeptoren besitzen eine Temperaturabhängigkeit, die jener der Kälterezeptoren sehr ähnlich ist. Der Unterschied zu spezifischen Kälterezeptoren besteht im Wesentlichen darin, dass diese durch moderate, nicht-schmerzhafte Druckreize nicht aktivierbar sind.
Molekulare Mechanismen
Elektrophysiologische Untersuchungen haben gezeigt, dass die Nervenimpulse (Aktionspotentiale) in peripheren Thermorezeptoren variable Muster aufweisen; dazu gehören beispielsweise typische Gruppen von Impulsen, so genannte
. Eine Vielzahl an Forschungsarbeiten hat zu der Annahme geführt, dass in der Zellhülle (Membran) dieser Rezeptoren durch das Zusammenspiel verschiedener Ionenkanäle oszillierende (sich zyklisch wiederholende) Prozesse ablaufen, deren Frequenz und Stärke (Amplitude) sich in Abhängigkeit von der Temperatur verändert, womit sich die unterschiedlichen Impulsmuster erklären lassen.[3]
Die molekularen Prozesse, welche die spezifischen Eigenschaften unterschiedlicher Thermorezeptoren bestimmen, werden seit einigen Jahren sehr intensiv auch durch direkte Messungen an thermosensitiven Ionenkanälen erforscht. Da dies an den schwer zugänglichen rezeptiven Nervenendigungen in der Haut bislang nicht möglich ist, werden solche Experimente an deren Zellkörpern in den Trigeminal- bzw. Spinalganglien vorgenommen.
Bei solchen Untersuchungen hat man festgestellt, dass in der Nervenzellmembran so genannte TRP-Kanäle (
) lokalisiert sind, die – zusammen mit weiteren Ionenkanälen – ganz offenbar eine wesentliche Rolle bei der Thermorezeption spielen. Solche Kanäle verändern sich in Reaktion auf einen Temperaturreiz derart, dass Ionen (vornehmlich geladene Natrium- oder Kalziumionen) im Inneren des Kanals durch die Membran strömen, wodurch sich das elektrische Potential der Zelle verändert.
Bislang ist eine Reihe unterschiedlicher thermosensitiver TRP-Kanäle nachgewiesen und charakterisiert worden, welche insbesondere für die dynamische Reaktion auf schnelle Temperaturänderungen verantwortlich sein könnten, durch die sich wärme- und kältsesensitive Rezeptoren unterscheiden. Es wurde bislang eine ganze Reihe von TRP-Kanälen nachgewiesen, die im Bereich zwischen Null und mehr als 50 °C jeweils in einem bestimmten, begrenzten Temperaturbereich aktiv sind. So hat die Forschung gezeigt, dass in Kaltrezeptoren der so genannte Melastatin- bzw. Kälte-Menthol-Rezeptor (TRPM8, CMR) eine entscheidende Rolle spielt; diese Rezeptoren sind zwischen ungefähr acht und 28 Grad aktiv.[4] Bei tieferen Temperaturen ist der so genannte Ankyrin-Rezeptor (TRPA1) aktiv, während bei höheren Temperaturen (bis in den Bereich des Hitzeschmerzes hinein) verschiedene Kanaltypen der Vanilloid-Rezeptorgruppe (TRPV1 bis 4) sowie der Melastatin-Gruppe (TRPM4 und 5) entsprechende Funktionen übernehmen. Eine Vielzahl von Untersuchungen weist darauf hin, dass die Kälte- bzw. Wärmerezeption in verschiedenen Tierarten bzw. in unterschiedlichen Geweben jeweils von einem fein ausbalancierten System unterschiedlicher Ionenkanäle gesteuert werden.[5] Trotz aller Forschungsfortschritte der letzten Jahre sind die detaillierten molekularen Mechanismen der Thermorezeption noch bei weitem nicht vollständig und abschließend aufgeklärt.
Zentrale Adaptation
Die Empfindung für eine bestimmte Temperatur nimmt allmählich ab, selbst wenn sie objektiv konstant bleibt (Sensorische Adaptation). Obwohl die Rezeptoren weiterhin die „aktuelle Temperatur“ übermitteln, findet im Zentralnervensystem eine Anpassung an den Reiz statt.
Im mittleren Temperaturbereich (zwischen 20 und 40 °C) führt eine Abkühlung oder Erwärmung nur vorübergehend zu einer Warm- bzw. Kaltempfindung, danach ist die Empfindung neutral (vollständige Adaptation). Dies lässt sich anhand eines warmen Bades leicht überprüfen.
Thermorezeption bei Tieren
Viele Tiere besitzen ähnliche Temperatursensoren wie der Mensch, einige Arten verfügen jedoch über einen weitaus effektiveren Wärmesinn. Dazu gehören beispielsweise die australischen Großfußhühner: Das Thermometerhuhn (Leipoa ocellata) misst mit Rezeptoren in seinem Schnabel die Brutwärme für seine Eier. Der Vogel bebrütet seine Eier nicht selbst, sondern nutzt die Gärungsprozesse in einem Haufen aus organischen Material zum Brüten. Die Hühner sind in der Lage, die Temperatur genau bei 33 °C zu halten. Indem sie den Hügel belüften bzw. vergrößern oder verkleinern vermögen sie die Temperatur feinfühlig zu regulieren.
Bei Schlangen hat sich die Fähigkeit infrarote Strahlung (Wärmestrahlung) wahrzunehmen in der Evolution unabhängig voneinander in drei verschiedenen Familien – Grubenottern (Crotalidae), Pythons (Pythonidae) sowie Boas (Boidae) – ausgebildet. Das Wärmesinnesorgan der Grubenottern (Unterfamilie Crotalinae), zu denen die Klapperschlangen gehören, beruht auf dem so genannten Bolometer-Prinzip und ermöglicht den Reptilien, Beutetiere selbst in völliger Dunkelheit zu lokalisieren und gezielte Bisse in bestimmte, leicht verletzbare Körperregionen auszuführen. Die Labialorgane der Boiden und Pythoniden bestehen aus Gruben entlang der Ober- bzw. Unterlippe. Inzwischen gibt es Hinweise darauf, dass Grubenottern ihren Wärmesinn auch für die Thermoregulation sowie für die Ortung potenzieller Räuber nutzen.[6] In den Rezeptoren und Ganglien bei Crotaliden findet man überwiegend TRP-Kanäle vom Ankyrin-Typ (TRPA1).
Auch die Vampirfledermaus (Desmodus rotundus) besitzt ein empfindliches Wärmesinnesorgan. Vampirfledermäuse (Unterfamilie Desmodontinae), die mit drei Arten ausschließlich in den Neotropen vorkommen, sind die einzigen Säugetiere, die sich ausschließlich von Blut ernähren. Im zentralen Teil des Nasenaufsatzes (dem „Nasenblatt“) von Desmodus, insbesondere auf dessen dünnem Rand sowie dem mittleren Grat, sind zahlreiche Kalt- und Warmrezeptoren (freie Nervenendigungen, s. o.) konzentriert, die vom Nervus trigeminus innerviert werden. Die Rezeptoren unterscheiden sich in ihren Eigenschaften von denen, die man bei anderen Säugetieren (Katzen, Hamster, Mäuse, Primaten einschließlich des Menschen) findet; so ist beispielsweise der Aktivitätsbereich der Warmrezeptoren zu niedrigeren, derjenige der Kaltrezeptoren zu höheren Temperaturen verschoben. Das Wärmesinnesorgan ermöglicht den Fledermäusen die von warmblütiger Beute (vor allem Rinder und Pferde, aber auch wildlebende Säugetiere) ausgehende Wärmestrahlung in Entfernungen bis zu 13 Zentimeter wahrzunehmen. Es wird vermutet, dass die Fledermäuse diesen Wärmesinn auch nutzen, um an ihrer Beute besonders stark durchblutete Körperstellen zu lokalisieren. Jüngst hat die Forschung nachgewiesen, dass in den Sinneszellen des Nasenaufsatzes von Desmodus TRP-Moleküle aktiv sind, die im Tierreich bislang einzigartig sind: Hier findet sich gehäuft ein Molekül (TRPV1-S), das im Vergleich zum „normalen“ TRPV1 eine veränderte Struktur und modifizierte Eigenschaften aufweist: Während TRPV1 ab etwa 43 Grad aktiv ist und somit einen Hitzeschmerzsensor darstellt, reagiert die kurze Version schon auf Temperaturen ab etwa 30 Grad.[7][8] Dieser Wert stimmt perfekt mit den Schwellen überein, die schon bei physiologischen Untersuchungen an den Warmrezeptoren dieser Fledermäuse gefunden worden waren.[9] Die zentrale Gesichtsregion von Desmodus bildet somit ein regelrechtes „Wärmesinnesorgan“.
Beispiele für leistungsfähige Wärmesinnesorgane finden sich ebenfalls bei den Insekten. Eine Reihe von Schmetterlingsarten, etwa aus den Gattungen Troides, Vanessa oder Pachliopta besitzen Thermosensoren in ihren Antennen bzw. in den Venen der Flügel.[10] Diese helfen den Insekten, ihre Körpertemperatur zu regulieren und eine Überhitzung zu verhindern. Dazu verändern die Tiere bei zu großer Hitzeeinwirkung zum Beispiel den Anstellwinkel ihrer Flügel im Verhältnis zur Sonneneinstrahlung.
Bei der blutsaugenden Wanze Triatoma infestans gibt es starke Hinweise darauf, dass die Tiere Infrarotstrahlung aus Distanz wahrnehmen können. Offenbar befinden sich die entsprechenden IR-Rezeptoren auf den Antennen.[11]
Außergewöhnliche Sinnesleistungen vollbringt der Schwarze Kiefernprachtkäfer Melanophila acuminata. Diese Insekten können große Waldbrände aus Entfernungen von bis zu einhundert Kilometer orten. Melanophila legt seine Eier ausschließlich in durch Feuer geschädigte Bäume. Die ausgeschlüpften Larven ernähren sich, ungestört von Fresskonkurrenz, von dem verbrannten Holz. Die Käfer besitzen neben zahlreichen chemischen Sinnesfühlern auch IR-Sinnesorgane, die in Gruben beiderseits des Brustkorbes (Thorax) nahe dem mittleren Beinpaar angeordnet sind.[12] Inzwischen weiß man, dass die IR-Strahlung in den Sinnesorganen in einen mechanischen Reiz umgewandelt wird, der dann von entsprechenden Sinneshaaren aufgenommen wird.[13] IR-Rezeptoren hat man auch bei der (ebenfalls Feuer suchenden) australischen Käferart Acanthocnemus nigricans entdeckt; diese basieren allerdings auf dem Bolometer-Prinzip[14] und ähneln damit eher den Sinnesorganen der Grubenottern.
Siehe auch
Literatur
- Schmidt, Thews: Physiologie des Menschen. 26. Auflage, 1995
- Klinke, Silbernagl: Lehrbuch der Physiologie. 6. Auflage, Georg Thieme Verlag, Stuttgart 2009
- Holger Münzel: Max von Frey. Leben und Wirken unter besonderer Berücksichtigung seiner sinnesphysiologischen Forschung. Würzburg 1992 (= Würzburger medizinhistorische Forschungen, 53), S. 47–66 (Der Temperatursinn).
Weblinks
- Literatur von und über Thermorezeption im Katalog der Deutschen Nationalbibliothek
- Audiofeature über das Phänomen des Temperaturempfindens auf Bayern2 Mediathek RadioWissen
- Der Webersche-Drei-Schalen-Versuch zur Temperaturwahrnehmung
Einzelnachweise
- ↑ The Nobel Prize.org: Press release: The Nobel Prize in Physiology or Medicine 2021. IN: Nobel Prize Outreach AB, 17. Oktober 2021
- ↑ K. Schäfer, H. A. Braun, L. Kürten: Analysis of cold and warm receptor activity in vampire bats and mice. In: Pflügers Archiv : European journal of physiology. Band 412, Nummer 1–2, Juli 1988, S. 188–194, ISSN 0031-6768. PMID 3174381.
- ↑ H.A Braun, M.T Huber, N. Anthes, K. Voigt, A. Neiman, X. Pei, F. Moss: Interactions between slow and fast conductances in the Huber/Braun model of cold-receptor discharges. In: Neurocomputing. 32–33, 2000, S. 51–59, doi:10.1016/S0925-2312(00)00143-0.
- ↑ Diana M. Bautista, Jan Siemens, Joshua M. Glazer, Pamela R. Tsuruda, Allan I. Basbaum, Cheryl L. Stucky, Sven-Eric Jordt, David Julius: The menthol receptor TRPM8 is the principal detector of environmental cold. In: Nature. 448, 2007, S. 204–208, doi:10.1038/nature05910.
- ↑ R. Madrid, E. de la Pena, T. Donovan-Rodriguez, C. Belmonte, F. Viana: Variable Threshold of Trigeminal Cold-Thermosensitive Neurons Is Determined by a Balance between TRPM8 and Kv1 Potassium Channels. In: Journal of Neuroscience. 29, 2009, S. 3120–3131, doi:10.1523/JNEUROSCI.4778-08.2009.
- ↑ A. R. Krochmal: Heat in evolution's kitchen: evolutionary perspectives on the functions and origin of the facial pit of pitvipers (Viperidae: Crotalinae). In: Journal of Experimental Biology. 207, 2004, S. 4231–4238, doi:10.1242/jeb.01278.
- ↑ Elena O. Gracheva, Julio F. Cordero-Morales, José A. González-Carcaia, Nicholas T. Ingolia, Carlo Manno, Carla I. Aranguren, Jonathan S. Weissman, David Julius: Ganglion-specific splicing of TRPV1 underlies infrared sensation in vampire bats. In: Nature. 476, 2011, S. 88–91, doi:10.1038/nature10245.
- ↑ George Wigmore: Vampire bats turn down the heat sensors to hunt. In: Nature. 2011, online, doi:10.1038/news.2011.454.
- ↑ Ludwig Kürten, Uwe Schmidt, Klaus Schäfer: Warm and cold receptors in the nose of the vampire bat Desmodus rotundus. In: Naturwissenschaften. 71, 1984, S. 327–328, doi:10.1007/BF00396621.
- ↑ Helmut Schmitz, Lutz T. Wasserthal: Antennal thermoreceptors and wing-thermosensitivity of heliotherm butterflies: Their possible role in thermoregulatory behavior. In: Journal of Insect Physiology. 39, 1993, S. 1007–1019, doi:10.1016/0022-1910(93)90125-B.
- ↑ Claudio Ricardo Lazzari, José Antonio Nunez: The response to radiant heat and the estimation of the temperature of distant sources in Triatoma infestans. In: Journal of Insect Physiology. 35, 1989, S. 525–529, doi:10.1016/0022-1910(89)90060-7.
- ↑ Helmut Schmitz, Horst Bleckmann: The photomechanic infrared receptor for the detection of forest fires in the beetle Melanophila acuminata (Coleoptera: Buprestidae). In: Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 182, 1998, S. 647–657, doi:10.1007/s003590050210.
- ↑ Anke Schmitz, Angelika Sehrbrock, Helmut Schmitz: The analysis of the mechanosensory origin of the infrared sensilla in Melanophila acuminata (Coleoptera; Buprestidae) adduces new insight into the transduction mechanism. In: Arthropod Structure & Development. 36, 2007, S. 291–303, doi:10.1016/j.asd.2007.02.002.
- ↑ Helmut Schmitz, Anke Schmitz, Stefan Trenner, Horst Bleckmann: A new type of insect infrared organ of low thermal mass. In: Naturwissenschaften. 89, 2002, S. 226–229, doi:10.1007/s00114-002-0312-4.