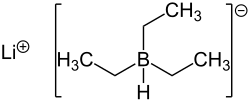
Lithiumtriethylborhydrid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumtriethylborhydrid | |||||||||||||||
| Andere Namen |
Lithiumtriethylhydridoborat | |||||||||||||||
| Summenformel | C6H16BLi | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 105,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,892 g·cm−3[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lithiumtriethylborhydrid ist eine chemische Verbindung aus der Gruppe der Organoborverbindungen.
Gewinnung und Darstellung
Lithiumtriethylborohydrid kann durch Reaktion von Lithiumhydrid mit Triethylboran in Diethylether bei 0 °C gewonnen werden.[2] Ebenfalls möglich ist die Synthese durch Reaktion von Triethylboran mit tert-Butyllithium oder Lithiumaluminiumhydrid in Gegenwart von Triethylendiamin.[3] Auch weitere Darstellungsmethoden sind bekannt.[4]
Eigenschaften
Lithiumtriethylborhydrid ist eine Flüssigkeit, die mischbar mit Tetrahydrofuran und Benzol ist.[1]
Verwendung
Lithiumtriethylborhydrid wird als starkes Reduktionsmittel bei organischen Synthesen zur Umwandlung von Carbonylverbindungen in Alkohole, bei der Herstellung von Alkinylalkoholen aus der Spaltung von cyclischen Ketovinyltriflate oder bei der Reduktion von Estern und Lactonen zu Alkoholen bzw. Diolen eingesetzt. Weiterhin wird es zur Herstellung von 1-Methylcyclohexanol und 1,4-Butandiol aus 1,2-Epoxybutan bzw. Gamma-Butyrolacton verwendet, sowie zur Herstellung von 2-Methylcyclohexanol aus 2-Methylcyclohexanon.[5] Es wird auch zur reduktiven Spaltung von Mesylaten und Tosylaten in der synthetischen organischen Chemie eingesetzt.[1][6]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Lithium triethylborohydride, 1M in THF bei AlfaAesar, abgerufen am 30. Januar 2019 (PDF) (JavaScript erforderlich).
- ↑ Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 6 Boron Compounds. Georg Thieme Verlag, 2014, ISBN 3-13-171761-0, S. 84 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Marek Zaidlewicz, Herbert C. Brown, Ameya S. Kulkarni, P. Veeraraghavan Ramachandran: Lithium Triethylborohydride. In: Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rl148.pub2
- ↑ E. W. Abel: Organometallic Chemistry. Royal Society of Chemistry, 1973, ISBN 978-0-85186-511-9, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Herbert C. Brown, S. C. Kim, S. Krishnamurthy: Selective reductions. 26. Lithium triethylborohydride as an exceptionally powerful and selective reducing agent in organic synthesis. Exploration of the reactions with selected organic compounds containing representative functional groups. In: The Journal of Organic Chemistry. 45, 1980, S. 1, doi:10.1021/jo01289a001.
- ↑ S. Krishnamurthy, Herbert C. Brown: Selective reductions. 31. Lithium triethylborohydride as an exceptionally powerful nucleophile. A new and remarkably rapid methodology for the hydrogenolysis of alkyl halides under mild conditions. In: The Journal of Organic Chemistry. 48, 1983, S. 3085, doi:10.1021/jo00166a031.


